
5.相等向量定义:
长度相等且方向相同的向量叫相等向量.
(1)向量a与b相等,记作a=b;
(2)零向量与零向量相等;
(3)任意两个相等的非零向量,都可用同一条有向线段来表示,并且与有向线段的起点无关.
4.平行向量定义:
①方向相同或相反的非零向量叫平行向量;
 ②我们规定0与任一向量平行.向量a、b、c平行,记作a∥b∥c.
②我们规定0与任一向量平行.向量a、b、c平行,记作a∥b∥c.
3.零向量、单位向量概念:
①长度为0的向量叫零向量,记作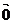

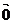 的方向是任意的
的方向是任意的
②长度为1个单位长度的向量,叫单位向量.零向量、单位向量的定义都是只限制大小,不确定方向.
2.向量的表示方法:①用有向线段表示;②用字母a、b等表示;
③用有向线段的起点与终点字母: ;
;
④向量 的大小――长度称为向量的模,记作|
的大小――长度称为向量的模,记作| |.
|.
1.向量的概念:我们把既有大小又有方向的量叫向量
(二)选考题:请考生从给出的2道化学题中任选一题做答,在答题卡选答区域指定位置答题。如果多做,则每学科按所做的第一题计分)
11.(15分)市场销售的某种食用精制盐包装袋上有如下说明:
|
产品标准 |
GB5461 |
|
产品等级 |
一级 |
|
配 料 |
食盐、碘酸钾、抗结剂 |
|
碘含量(以I计) |
20-50 mg/kg |
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空白处)
KIO3+ KI+ H2SO4= K2SO4+ I2+ H2O
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。
①Na2SO3稀溶液与I2反应的离子方程式是 。
②某学生设计回收四氯化碳的操作步骤为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量Na2SO3稀溶液;
c.分离出下层液体。
以上设计中遗漏的操作及在上述步骤中的位是 ;所缺步骤为 。
(3)已知:I2+2S2O32-=2I-+S4O62-。某学生测定食用精制盐的碘含量,其步骤为:
a. 准确称取12.7g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为6.0×10-4mol·L-1的Na2S2O3溶液20.0mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是 。
②根据以上实验和包装袋说明,所测精制盐的碘含量是 mg/kg
12.(15分)四只试剂瓶中分别盛装有NaNO3溶液、Na2CO3溶液、Na2SO4溶液和NaCl溶液,就如何检验这四种溶液分别解答下列各题。在四支试管中分别取四种溶液各1mL,做下列实验。
⑴在四支试管中分别滴入 ,出现 现象的是 ,离子方程式是 。
(2)在剩余三支试管中分别滴入 ,出现 现象的是 。离子方程式是_______________________________ .
(3)在剩余两支试管中分别滴入 ,出现 现象的是 ,
三次实验中都没有明显现象的是 。
(一)必考题(3题,共43分)
8.(10分)物质的分离是化学研究中常用的方法,填写下列物质分离时需使用的方法(不必叙述操作细节)
(1)两种互不相溶的液体的分离 。
(2)固体和液体的分离 。
(3)含固体溶质的溶液中除去部分溶剂 。
(4)胶体中分离出可溶电解质 。
(5)几种沸点相差较大的互溶液体的分离 。
9.(17分)有下列化学仪器:
①托盘天平②玻璃棒③药匙④烧杯⑤量筒⑥容量瓶⑦胶头滴管⑧细口试剂瓶⑨标签纸
(1)现需要配制480m L 1mol/L H2SO4溶液,需要质量分数为98%,密度为1.84g/cm3的浓H2SO4 ;
(2)从上述仪器中,按实验要求使用的先后顺序,其编号排列是 ;
(3)容量瓶使用前检验漏水的方法是 ;
(4)若实验遇到下列情况,对硫酸溶液的物质的量浓度有何影响(填“偏高”“偏低”或“不变”)
①用以稀释浓硫酸的烧杯未洗涤, ;
②未经冷却将溶液注入容量瓶中, ;
③摇匀后发现液面下降再加水, ;
④定容时观察液面俯视, ;
⑤量取浓硫酸时仰视看液面________.
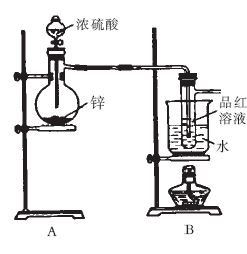
10.(16分)某研究性学习小组对Zn跟一定量的浓硫酸反应生成的气体产物进行探究。
 [提出假设]
[提出假设]
小组同学经过分析讨论认为生成气体可能含
H2和SO2。
(1)认为生成气体中含H2的理由是
。
[设计实验方案,验证假设]主要包括两个
环节:
I.验证SO2,实验装置如右图所示;
Ⅱ.检验产物中含有H2,实验内容为将由B部
分导出的气体依次通过装置C、D、E、F。
(2)盛放锌粒的仪器名称是 。
(3)B部分装置的目的是验证SO2并探究SO2与
品红作用的可逆性。实验中操作及现象是
。
(4)Ⅱ中装置C、D、E、F、G的信息如下表所示:
|
仪器标号 |
C |
D |
E |
F |
|
仪器 |
洗气瓶 |
洗气瓶 |
硬质玻璃管,加热 |
干燥管 |
|
仪器中所加物质 |
NaOH溶液 |
浓硫酸 |
CuO粉末 |
试剂X |
①装置C、D的作用依次是 、 。
②E中发生反应的化学方程式是 。
③试剂X是 。
(5)有人提出方案Ⅱ在确认产物中存在H2并不严密,请你提出改进建议:
_______________________________________________________
7.标准状况下,往100mL 0.1mol/L的FeBr2溶液中通入一定体积的Cl2,充分反应后,溶液中有50%的Br-被氧化。则通入的氯气的体积是
A.0.224L B.0.336L C.0.448L D.0.672L
6.在水电离出的C(H+)=10-14mol/L的溶液中,一定能大量共存的离子组是
A.K+、Na+、HCO3-、Cl- B.K+、AlO2-、Br-、Cl-
C.Na+、Cl-、NO3-、SO42- D.Al3+、NH4+、Cl-、SO42-
5.某溶液中含有HCO、SO、CO、CH3COO- 4种阴离子.若向其中加入足量的Na2O2后,溶液中离子浓度基本保持不变的是
A.CH3COO- B.SO C.CO D.HCO
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com