
8.
 下列叙述中正确的是
下列叙述中正确的是

 A. 向含有CaCO3沉淀的水中通入CO2 至沉淀恰好溶解,再向溶液中加入NaHCO3 饱
A. 向含有CaCO3沉淀的水中通入CO2 至沉淀恰好溶解,再向溶液中加入NaHCO3 饱

 和溶液,又有CaCO3沉淀生成
和溶液,又有CaCO3沉淀生成

 B. 向Na2
CO3溶液中逐滴加入等物质的量的稀盐酸,生成的CO2与原Na2 CO3的物质的量之比为1:2.
B. 向Na2
CO3溶液中逐滴加入等物质的量的稀盐酸,生成的CO2与原Na2 CO3的物质的量之比为1:2.

 C. 等质量的NaHCO3和Na2 CO3分别与足量盐酸反应,在同温同压下,生成的CO2体积相同
C. 等质量的NaHCO3和Na2 CO3分别与足量盐酸反应,在同温同压下,生成的CO2体积相同

 D. 向Na2
CO3饱和溶液中通入CO2,有NaHCO3结晶析出
D. 向Na2
CO3饱和溶液中通入CO2,有NaHCO3结晶析出

 答案D
答案D
 [解析]CaCO3与CO2反应生成Ca(HCO3)2,再加入NaHCO3是没有现象的,A项错;向Na2CO3溶液中逐滴加入等物质的量的稀盐酸,仅生成NaHCO3,无CO2气体放出,B项错;等质量的NaHCO3和Na2CO3,其中NaHCO3的物质的量多,与足量HCl反应时,放出的CO2多,C项错;D项,发生的反应为:Na2CO3 + CO2 + H2O
=2NaHCO3↓,由于NaHCO3的溶解性较小,故有结晶析出,正确。
[解析]CaCO3与CO2反应生成Ca(HCO3)2,再加入NaHCO3是没有现象的,A项错;向Na2CO3溶液中逐滴加入等物质的量的稀盐酸,仅生成NaHCO3,无CO2气体放出,B项错;等质量的NaHCO3和Na2CO3,其中NaHCO3的物质的量多,与足量HCl反应时,放出的CO2多,C项错;D项,发生的反应为:Na2CO3 + CO2 + H2O
=2NaHCO3↓,由于NaHCO3的溶解性较小,故有结晶析出,正确。
7.
 下列关于溶液和胶体的叙述,正确的是
下列关于溶液和胶体的叙述,正确的是

 A. 溶液是电中性的,胶体是带电的
A. 溶液是电中性的,胶体是带电的

 B. 通电时,溶液中的溶质粒子分别向两极移动,胶体中的分散质粒子向某一极移动
B. 通电时,溶液中的溶质粒子分别向两极移动,胶体中的分散质粒子向某一极移动

 C. 溶液中溶质粒子的运动有规律,胶体中分散质粒子的运动无规律,即布朗运动
C. 溶液中溶质粒子的运动有规律,胶体中分散质粒子的运动无规律,即布朗运动

 D. 一束光线分别通过溶液和胶体时,后者会出现明显的光带,前者则没有
D. 一束光线分别通过溶液和胶体时,后者会出现明显的光带,前者则没有

 答案D
答案D
 [解析]胶体本身是不带电,只是其表面积较大,吸附了溶液中的离子而带了电荷,故A项错;溶液中的溶质,要看能否电离,若是非电解质,则不导电,也即不会移动,B项错;溶液中溶质粒子没有规律,C项错;丁达尔效应可以用来区分溶液和胶体,D项正确。
[解析]胶体本身是不带电,只是其表面积较大,吸附了溶液中的离子而带了电荷,故A项错;溶液中的溶质,要看能否电离,若是非电解质,则不导电,也即不会移动,B项错;溶液中溶质粒子没有规律,C项错;丁达尔效应可以用来区分溶液和胶体,D项正确。

30、(15分)
化合物H是一种香料,存在于金橘中,可用如下路线合成:
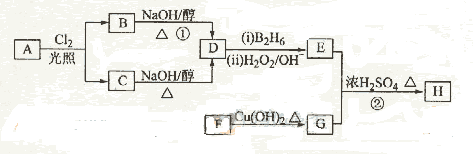
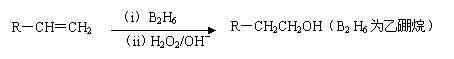
已知:
回答下列问题:
(1)11.2L(标准状况)的烃A在氧气中充分燃烧可以产生88 g CO2和45 g H2O。
A的分子式是________________
(2)B和C均为一氯代烃,它们的名称(系统命名)分别为___________________________________________________;
(3)在催化剂存在下1 mol F与2 mol H2反应,生成3-苯基-1-丙醇。F的结构简式是_____________
(4)反应①的反应类型是__________________;
(5)反应②的化学方程式为__________________________
(6)写出所有与G具有相同官能团的G的芳香类同分异构体的结构简式:
__________________________________
答案(1)C4H10。(2)2-甲基-1-氯丙烷、2-甲基-2-氯丙烷(3) (4)消去反应。
(4)消去反应。
(5)

(6) 、
、 、
、 、
、
[解析](1)88gCO2为2mol,45gH2O为2.5mol,标准11.2L,即为0.5mol,所以烃A中含碳原子为4,H原子数为10,则化学式为C4H10。(2)C4H10存在正丁烷和异丁烷两种,但从框图上看,A与Cl2光照取代时有两种产物,且在NaOH醇溶液作用下的产物只有一种,则只能是异丁烷。取代后的产物为2-甲基-1-氯丙烷和2-甲基-2-氯丙烷。(3)F可以与Cu(OH)2反应,故应为醛基,与H2之间为1:2加成,则应含有碳碳双键。从生成的产物3-苯基-1-丙醇分析,F的结构简式为
 。(4)反应①为卤代烃在醇溶液中的消去反应。(5)F被新制的Cu(OH)2氧化成羧酸,D至E为然后与信息相同的条件,则类比可不难得出E的结构为
。(4)反应①为卤代烃在醇溶液中的消去反应。(5)F被新制的Cu(OH)2氧化成羧酸,D至E为然后与信息相同的条件,则类比可不难得出E的结构为 。E与G在浓硫酸作用下可以发生酯化反应。(5)G中含有官能团有碳碳双键和羧基,可以将官能团作相应的位置变换而得出其芳香类的同分异构体。
。E与G在浓硫酸作用下可以发生酯化反应。(5)G中含有官能团有碳碳双键和羧基,可以将官能团作相应的位置变换而得出其芳香类的同分异构体。
======================================================================================

 [全国卷II]6. 物质的量之比为2:5的锌与稀硝酸反应,若硝酸被还原的产物为N2O,反应结束后锌没有剩余,则该反应中被还原的硝酸与未被还原的硝酸的物质的量之比是
[全国卷II]6. 物质的量之比为2:5的锌与稀硝酸反应,若硝酸被还原的产物为N2O,反应结束后锌没有剩余,则该反应中被还原的硝酸与未被还原的硝酸的物质的量之比是

 A. 1:4 B.1:5 C. 2:3 D.2:5
A. 1:4 B.1:5 C. 2:3 D.2:5

 答案A
答案A
 [解析]设2molZn参与反应,因Zn无剩余,则最终生成了2molZn(NO3)2,显然含有4molNO3-
,这部分是没有参与氧化还原反应的HNO3,根据得失电子守恒有:2×n(Zn)=n(HNO3)×4,则n(HNO3)=1mol,即有1molHNO3被还原。
[解析]设2molZn参与反应,因Zn无剩余,则最终生成了2molZn(NO3)2,显然含有4molNO3-
,这部分是没有参与氧化还原反应的HNO3,根据得失电子守恒有:2×n(Zn)=n(HNO3)×4,则n(HNO3)=1mol,即有1molHNO3被还原。

29.(15分)(注意:在试题卷上作答无效)
已知周期表中,元素Q、R、W、Y与元素X相邻。Y的最高化合价氧化物的水化物是强酸。回答下列问题:
(1)W与Q可以形成一种高温结构陶瓷材料。W的氯化物分子呈正四面体结构,W的氧化物的晶体类型是 ;
(2)Q的具有相同化合价且可以相互转变的氧化物是 ;
(3)R和Y形成的二元化合物中,R呈现最高化合价的化合物的化学式是 ;
(4)这5个元素的氢化物分子中,①立体结构类型相同的氢化物的沸点从高到低排列次序是(填化学式) ,其原因是
;
②电子总数相同的氢化物的化学式和立体结构分别是
;
(5)W和Q所形成的结构陶瓷材料的一种合成方法如下:W的氯化物与Q的氢化物加热反应,生成化合物W(QH2)4和HCL气体;W(QH2)4在高温下分解生成Q的氢化物和该陶瓷材料。上述相关反应的化学方程式(各物质用化学式表示)是
。
答案(1)原子晶体。(2)NO2和N2O4(3)As2S5。(4)①NH3> AsH3 > PH3,因为前者中含有氢键,后两者构型相同,分子间作用力不同;②电子数相同的有SiH4、PH3和H2S结构分别为正四面体,三角锥和V形。(5)SiCl4 + 4NH3 = Si(NH2)4 + 4HCl,3Si(NH2)4 = 8NH3 + Si3N4
 [解析]本题可结合问题作答。W的氯化物为正四体型,则应为SiCl4或CCl4,又W与Q形成高温陶瓷,故可推断W为Si。(1)SiO2为原子晶体。(2)高温陶瓷可联想到Si3N4,Q为N,则有NO2与N2O4之间的相互转化关系。(3)Y的最高价氧化的的水化物为强酸,且与Si、N等相邻,则只能是S。R为As,所以R的最高价化合物应为As2S5。(4)显然x为P元素。①氢化物沸点顺序为NH3>
AsH3 > PH3,因为前者中含有氢键后两者构型相同,分子间作用力不同。②SiH4、PH3和H2S的电子数均为18。,结构分别为正四面体,三角锥和V形。(5)由题中所给出的含字母的化学式可以写出具体的物质,然后配平即可。
[解析]本题可结合问题作答。W的氯化物为正四体型,则应为SiCl4或CCl4,又W与Q形成高温陶瓷,故可推断W为Si。(1)SiO2为原子晶体。(2)高温陶瓷可联想到Si3N4,Q为N,则有NO2与N2O4之间的相互转化关系。(3)Y的最高价氧化的的水化物为强酸,且与Si、N等相邻,则只能是S。R为As,所以R的最高价化合物应为As2S5。(4)显然x为P元素。①氢化物沸点顺序为NH3>
AsH3 > PH3,因为前者中含有氢键后两者构型相同,分子间作用力不同。②SiH4、PH3和H2S的电子数均为18。,结构分别为正四面体,三角锥和V形。(5)由题中所给出的含字母的化学式可以写出具体的物质,然后配平即可。
28.(15分)(注意:在试题卷上作答无效)
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极。

(1) 接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加。据此回答问题:
①电源的N端为 极;
②电极b上发生的电极反应为 ;
③列式计算电极b上生成的气体在标准状态下的体积: ;
④电极c的质量变化是 g;
⑤电解前后各溶液的酸、碱性大小是否发生变化,简述其原因:
甲溶液 ;
乙溶液 ;
丙溶液 ;
(2)如果电解过程中铜全部析出,此时电解能否继续进行,为什么?
答案(1)①正极 ②4OH--4e-=2H2O + O2↑。③2.8L ④16g ⑤甲增大,因为相当于电解水;乙减小,OH-放电, H+增多。丙不变,相当于电解水。(2)可以 因为CuSO4溶液已转变为H2SO4溶液,反应也就变为水的电解反应
[解析](1)①乙中C电极质量增加,则c处发生的反应为:Cu2++2e-=Cu,即C处为阴极,由此可推出b为阳极,a为阴极,M为负极,N为正极。丙中为K2SO4,相当于电解水,设电解的水的质量为xg。由电解前后溶质质量相等有,100×10%=(100-x)×10.47%,得x=4.5g,故为0.25mol。由方程式2H2+O2  2H2O可知,生成2molH2O,转移4mol电子,所以整个反应中转化0.5mol电子,而整个电路是串联的,故每个烧杯中的电极上转移电子数是相等的。②甲中为NaOH,相当于电解H2O,阳极b处为阴离子OH-放电,即4OH--4e-=2H2O + O2↑。③转移0.5mol电子,则生成O2为0.5/4=0.125mol,标况下的体积为0.125×22.4=2.8L。④Cu2++2e-=Cu,转移0.5mol电子,则生成的m(Cu)=0.5/2 ×64 =16g。⑤甲中相当于电解水,故NaOH的浓度增大,pH变大。乙中阴极为Cu2+放电,阳极为OH-放电,所以H+增多,故pH减小。丙中为电解水,对于K2SO4而言,其pH几乎不变。(2)铜全部析出,可以继续电解H2SO4,有电解液即可电解。
2H2O可知,生成2molH2O,转移4mol电子,所以整个反应中转化0.5mol电子,而整个电路是串联的,故每个烧杯中的电极上转移电子数是相等的。②甲中为NaOH,相当于电解H2O,阳极b处为阴离子OH-放电,即4OH--4e-=2H2O + O2↑。③转移0.5mol电子,则生成O2为0.5/4=0.125mol,标况下的体积为0.125×22.4=2.8L。④Cu2++2e-=Cu,转移0.5mol电子,则生成的m(Cu)=0.5/2 ×64 =16g。⑤甲中相当于电解水,故NaOH的浓度增大,pH变大。乙中阴极为Cu2+放电,阳极为OH-放电,所以H+增多,故pH减小。丙中为电解水,对于K2SO4而言,其pH几乎不变。(2)铜全部析出,可以继续电解H2SO4,有电解液即可电解。
27.(15分)(注意:在试题卷上作答无效)
浓H2SO4和木炭在加热时发生反应的化学方程式是
2 H2SO4 (浓) + C  CO2↑+ 2 H2O + 2SO2↑
CO2↑+ 2 H2O + 2SO2↑
请从下图中选用所需的仪器(可重复选用)组成一套进行该反应并检出反应产物的装置。现提供浓H2SO4、木炭和酸性KMnO4溶液,其他固、液试剂自选。(连接和固定仪器用的玻璃管、胶管、铁夹、铁架台及加热装置等均略去)
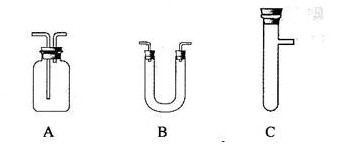
将所选的仪器按连接顺序由上至下依次填入下表,并写出该仪器中应加试剂的名称及其作用。
|
选用的仪器 (填字母) |
加入的试剂 |
作用 |
|
|
|
|
答案C 浓硫硫和木炭 产生反应物
B 无水硫酸铜 检验是否有水
A 品红 检验SO2
A 酸性KMnO4 除去SO2
A 澄清石灰水 检验CO2的存在。
[解析]成套装置包括反应装置,检验装置和尾气处理装置。C中加入浓硫硫和木炭作为反应物的发生器,产物中必须先检验水,因为在检验其他物质时会在其它试剂中混入水,可选用装置B,放入无水硫酸铜,若变蓝则说明有水。接着检验SO2气体,用装置A,放入品红检验,若品红褪色,则说明有SO2气体产生,再用装置A,放入酸性KMnO4溶液以除去SO2,最后再用装置A,放入澄清石灰水来检验CO2的存在,因SO2也可以使澄清石灰水变浑,故先要除去SO2。
13. 下图表示反应
下图表示反应

 ,
, ,在某温度时
,在某温度时 的浓度随时间变化的曲线:
的浓度随时间变化的曲线:
下列有关该反应的描述正确的是
A.第6 后,反应就终止了
后,反应就终止了
B. 的平衡转化率为85%
的平衡转化率为85%
C.若升高温度, 的平衡转化率将大于85%
的平衡转化率将大于85%
D.若降低温度,v正和v逆将以同样倍数减少
答案B
[解析]A项,6min时反应达平衡,但未停止,故错;B项,X的变化量为1-0.15=0.85mol,转化率为0.85/1=85%,正确。H<0,反应为放热,故升高温度,平衡将逆向移动,则X的转化率减小,C项错;D项,降温,正、逆反应速率同时减小,但是降温平衡正向移动,故V正>V逆,即逆反应减小的倍数大,错误。
12. 有关下图所示化合物的说法不正确的是

A.既可以与Br2的CCl4溶液发生加成反应,又可以在光照下与Br2发生取代反应
B.1mol该化合物最多可以与3molNaOH反应
C.既可以催化加氢,又可以使酸性KmnO4溶液褪色
D.既可以与FeCl3溶液发生显色反应,又可以与NaHCO3溶液反应放出CO2气体
答案D
[解析]有机物含有碳碳双键,故可以与Br2发生加成反应,又含有甲基,故可以与Br2光照发生取代反应,A项正确;B项,酚羟要消耗一个NaOH,两个酯基要消耗两个NaOH,正确;C项,苯环可以催化加氢,碳碳双键可以使KMnO4褪色,正确;该有机物中不存在羧基,故不能与NaHCO3放出CO2气体,D项错。
11.为了检验某含有 杂质的
杂质的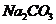 样品的纯度,现将
样品的纯度,现将 克样品加热,其质量变为
克样品加热,其质量变为 g,,则该样品的纯度(质量分数)是
g,,则该样品的纯度(质量分数)是
A.
B.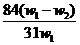
C.
D.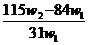
答案A
[解析]2NaHCO3  Na2CO3 + CO2↑ + H2O m (减少)
Na2CO3 + CO2↑ + H2O m (减少)
2×84 106 62
x (W1- w2)
解得x= ,将其带入下式可得: w(Na2CO3)= (w1- x )/W1 =
,将其带入下式可得: w(Na2CO3)= (w1- x )/W1 =  ,A项正确。
,A项正确。
10.用0.1 mol•. 的盐酸滴定0.10 mol•.
的盐酸滴定0.10 mol•. 的氨水,滴定过程中不可能出现的结果是
的氨水,滴定过程中不可能出现的结果是
A. >
> ,
, >
> B.
B.  =
= ,
, =
=
C. >
> ,
, >
> D.
D.  >
> ,
, >
>
答案C
[解析]溶液中不可能出现阴离子均大于阳离子的情况,不遵循电荷守恒,故C项错。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com