
1.如图1-1-8所示,A、B两物体叠放在一起,用手托住,让它们静靠在墙边,然后释放,它们同时沿竖直墙面自由下滑,已知mA>mB,则物体B
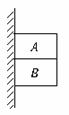
图1-1-8
A.只受一个重力 B.受到重力和一个摩擦力
C.受到重力、一个弹力和一个摩擦力 D.受到重力、一个摩擦力、两个弹力
[解析] 由于A、B与竖直墙壁间没有弹力,故它们也不受摩擦力,A、B一起做自由落体运动,它们之间也没有相互作用的弹力,故A和B都只受重力作用,A选项正确.
[答案] A
2.物体间保持相对静止但存在相对运动趋势时产生的摩擦力叫静摩擦力.静摩擦力的大小除最大值外无确定的表达式,其大小可为零与最大值间的任意值,具体大小由物体的受力情况和运动状态决定.静摩擦力的方向总是与物体相对运动趋势的方向相反,与物体对地的运动方向间无确定的关系,可能与物体对地的运动方向相同、相反、垂直或成任意角度,因此静摩擦力可以对物体做负功、正功或不做功,但在任何情况下,静摩擦力对相互作用的系统做功的代数和总为零,故静摩擦力做功不会改变系统的机械能,不会将机械能转化为内能.
●精典题例解读
[例1]如图1-1-1,C是水平地面,A、B是两个长方形物块,F是作用在B上沿水平方向的力,物体A和B以相同的速度做匀速直线运动.由此可知A、B间的动摩擦因数μ1和B、C间的动摩擦因数μ2可能是

图1-1-1
A.μ1=0 μ2=0 B.μ1=0 μ2≠0 C.μ1≠0 μ2=0 D.μ1≠0 μ2≠0
[解析] 选A、B整体为研究对象,由于B受推力F的作用还做匀速直线运动,可知地面对B的摩擦力一定水平向左,故μ2≠0,对A受力分析知,水平方向不受力,μ1可能为0,也可能不为0.故B、D正确.
小结:本题主要考查由物体的运动情况和所受其他力的情况来判断摩擦力的有无.A物体虽然随B物体一起运动,但它们之间并无相对运动的趋势,因此摩擦力为零.但却不能因此而得出它们之间的摩擦因数也为零的结论.
[例2]如图1-1-2所示,一质量为m的货物放在倾角为α的传送带上随传送带一起向上或向下做加速运动.设加速度大小为a,试求两种情况下货物所受的摩擦力F.
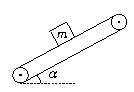
图1-1-2
[解析] 物体m向上加速运动时,由于沿斜面向下有重力的分力,所以要使物体随传送带向上加速运动,传送带对物体的摩擦力必定沿传送带向上.物体沿斜面向下加速运动时,摩擦力的方向要视加速度的大小而定,当加速度为某一合适值时,重力沿斜面方向的分力恰好提供了所需的合外力,则摩擦力为零;当加速度大于此值时,摩擦力应沿斜面向下;当加速度小于此值时,摩擦力应沿斜面向上.
向上加速运动时,由牛顿第二定律,得: F-mgsinα=ma
所以F=mgsinα+ma,方向沿斜面向上.
向下加速运动时,由牛顿第二定律,得:mgsinα-F=ma(设F沿斜面向上)
所以F=mgsinα-ma当α<gsinα时,F>0.与所设方向相同--沿斜面向上.
当a=gsinα时,F=0.即货物与传送带间无摩擦力作用.
当a>gsinα时,F<0.与所设方向相反--沿斜面向下.
小结:当物体加速运动而摩擦力方向不明确时,可先假设摩擦力向某一方向,然后应用牛顿第二定律导出表达式,再结合具体情况进行讨论.
[例3]如图1-1-3所示,一直角斜槽(两槽面间夹角为90°,两槽面跟竖直面的夹角均为45°),对水平面的倾角为θ,一个横截面为正方形的物块恰能沿此斜槽匀速下滑.假定两槽面的材料和槽面的情况相同,求物块和槽面之间的动摩擦因数μ.
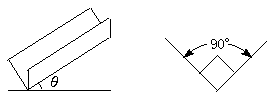
图1-1-3
[解析] 物块沿斜槽匀速下滑,说明物块所受摩擦力与重力在斜槽方向的分力相等.滑动摩擦力等于动摩擦因数与物体间正压力的乘积,要注意,此题中的正压力并不等于mgcosθ.正确画出受力图是解答此题的关键.
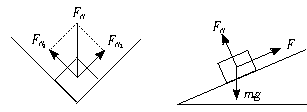 如图1-1-4所示,设左右槽面作用于物块的支持力分别为FN1、FN2,由于对称性,FN1=FN2,它们的合力FN垂直于槽底线,且
如图1-1-4所示,设左右槽面作用于物块的支持力分别为FN1、FN2,由于对称性,FN1=FN2,它们的合力FN垂直于槽底线,且
图1-1-4
FN=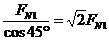 ①
①
相应的左、右两槽面作用于物块的滑动摩擦力Fμ1和Fμ2相等,它们的合力Fμ平行于槽底线,且
Fμ=2Fμ1=2μFN1 ②
根据平衡条件Fμ=mgsinθ,FN=mgcosθ
从上面两个方程得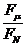 =tanθ ③
=tanθ ③
将①②代入③可得 μ= tanθ
tanθ
小结:求摩擦力大小时要特别注意以下问题:
(1)区分静摩擦力和滑动摩擦力.滑动摩擦力和静摩擦力的大小所遵循的规律不同,滑动摩擦力的大小与压力成正比,静摩擦力的大小与压力无关.
(2)物体在某一接触面上所受的滑动摩擦力与该接触面上的压力成正比.
[例4]如图1-1-5所示,质量M=10 kg的木楔ABC静止于粗糙水平地面上,动摩擦因数μ=0.02,在木楔的倾角θ为30°的斜面上有一质量m=1.0 kg的物块由静止开始沿斜面下滑.当滑行路程s=1.4 m时,其速度v=1.4 m/s,在这过程中木楔没有动,求地面对木楔的摩擦力的大小和方向.(g取10 m/s2).

图1-1-5
[解析] 地面对木楔的摩擦力为静摩擦力,但不一定为最大静摩擦力,所以不能由Fμ=μFN来计算求得,只能根据物体的运动情况和受力情况来确定.
物块沿斜面匀加速下滑,由vt2-v02=2as可求得物块下滑的加速度
a=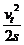 =0.7 m/s2<gsinθ=5 m/s2
=0.7 m/s2<gsinθ=5 m/s2
可知物块受到摩擦力的作用.
此条件下,物块与木楔受力情况分别如图1-1-6和图1-1-7所示.
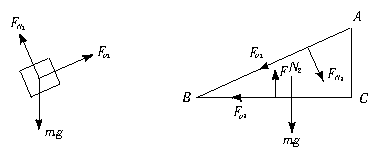
图1-1-6 图1-1-7
物块沿斜面以加速度a下滑,对它沿斜面方向和垂直于斜面方向由牛顿第二定律有
mgsinθ-Fμ1=ma
mgcosθ-FN1=0
木楔静止,对它沿水平方向和竖直方向由牛顿第二定律,并注意Fμ1′与Fμ1,FN1′与FN1等值反向,有
Fμ2+Fμ1cosθ-FN1sinθ=0
FN2-Mg-FN1cosθ-Fμ1sinθ=0
由上面各式解得地面对木楔摩擦力
Fμ2=FN1sinθ-Fμ1cosθ
=mgcosθsinθ-(mgsinθ-ma)cosθ
=macosθ=1.0×0.7×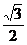 N=0.61 N
N=0.61 N
此力方向与所设方向相同,由C指向B.
另外由以上几式联立还可求出地面对木楔的支持力
FN2=Mg+mgcos2θ+(mgsinθ-ma)sinθ=Mg+mg-masinθ
=11×10 N-1.0×0.7×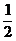 N=109.65 N<(m+M)g
N=109.65 N<(m+M)g
显然,这是由于物块和木楔系统有向下的加速度而产生了失重现象.
对此题也可以系统为研究对象.在水平方向,木楔静止,加速度为零;物块加速度的水平分量为ax=acosθ.对系统在水平方向由牛顿第二定律,有
Fμ2=max=macosθ=0.61 N
小结:(1)静摩擦力的大小是个变量,它的大小常需要根据物体的运动状态及摩擦力与物体所受其他力的关系来确定.(2)由此题可看出,研究对象的选取对解题步骤的简繁程度有很大的影响.
●应用强化训练
28. (15分)以黄铁矿为原料生产硫酸的工艺流程图如下:

(1)将燃烧黄铁矿的化学方程式补充完整
4
+11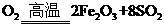
(2)接触室中发生反应的化学方程式是 。
(3)依据工艺流程图判断下列说法正确的是(选填序号字母) 。
a. 为使黄铁矿充分燃烧,需将其粉碎
b. 过量空气能提高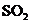 的转化率
的转化率
c. 使用催化剂能提高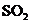 的反应速率和转化率
的反应速率和转化率
d. 沸腾炉排出的矿渣可供炼铁
(4)每160g 气体与
气体与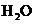 化合放出260.6kJ的热量,该反应的热化学方程是 。
化合放出260.6kJ的热量,该反应的热化学方程是 。
(5)吸收塔排出的尾气先用氨水吸收,再用浓硫酸处理,得到较高浓度的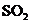 和铵盐。
和铵盐。
①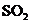 既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的
既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的 。
。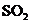 吸收
吸收 的离子方程式是
。
的离子方程式是
。
② 为测定该铵盐中氮元素的质量分数,将不同质量的铵盐分别加入到50.00mL相同浓度的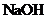 溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解)。该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量。
溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解)。该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量。
部分测定结果;
铵盐质量为10.00g和20.00g 时,浓硫酸增加的质量相同;铵盐质量为30.00g时,浓硫酸增加的质量为0.68g;铵盐质量为40.00g时,浓硫酸的质量不变。
计算:该铵盐中氮元素的质量分数是 %; 若铵盐质量为15.00g。 浓硫酸增加的质量为 。 (计算结果保留两位小数)
|
6 |
7 |
8 |
9 |
10 |
11 |
12 |
|
A |
B |
C |
C |
D |
B |
A |
27.(14分)某学习小组探究浓、稀硝酸氧化性的相对强弱的,按下图装置进行试验(夹持仪器已略去)。实验表明浓硝酸能将 氧化成
氧化成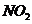 ,而稀硝酸不能氧化
,而稀硝酸不能氧化 。由此得出的结论是浓硝酸的氧化性强于稀硝酸。
。由此得出的结论是浓硝酸的氧化性强于稀硝酸。

可选药品:浓硝酸、3mo/L稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液及二氧化碳
已知:氢氧化钠溶液不与 反应,能与
反应,能与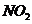 反应:
反应: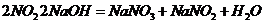
(1) 实验应避免有害气体排放到空气中,装置③、④、⑥中乘放的药品依次是
(2) 滴加浓硝酸之前的操作时检验装置的气密性,加入药品,打开弹簧夹后
(3) 装置①中发生反应的化学方程式是
(4) 装置②的作用是 ,发生反应的化学方程式是
(5) 该小组得出的结论一局的试验现象是
(6) 试验结束后,同学们发现装置①中溶液呈绿色,而不显蓝色。甲同学认为是该溶液中硝酸铜的质量分数较高所致,而乙同学认为是该溶液中溶解了生成的气体。同学们分别涉及了一下4个试验来判断两种看法是否正确。这些方案中可行的是(选填序号字母)
a. 加热该绿色溶液,观察颜色变化
b. 加水稀释绿色溶液,观察颜色变化
c. 向该绿色溶液中通入氮气,观察颜色变化
d. 向饱和硝酸铜溶液中通入浓硝酸与铜反映产生的气体,观察颜色变化
26.(15分)
以富含硫酸亚铁的工业废液为原料生产氧化铁的工艺如下(部分操作和条件略);
I 从废液中提纯并结晶处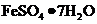 。
。
II将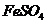 溶液与稍过量的
溶液与稍过量的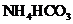 溶液混合,得到含
溶液混合,得到含 的浊液
的浊液
IV 将浊液过滤,用90°C热水洗涤沉淀,干燥后得到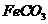 固体
固体
V煅烧 ,得到
,得到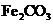 固体
固体
已知: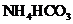 在热水中分解
在热水中分解
(1) I中,加足量的铁屑出去废液中的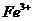 ,该反应的离子方程式是
,该反应的离子方程式是
(2) II中,需加一定量硫酸,运用化学平衡原理简述硫酸的作用
(3) III中,生成 的离子方程式是
。若
的离子方程式是
。若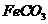 浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是
。
浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是
。
(4) IV中,通过检验 来判断沉淀是否洗涤干净。检验
来判断沉淀是否洗涤干净。检验 操作是是
。
操作是是
。
(5) 已知煅烧 的化学方程式是
的化学方程式是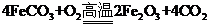 ,现煅烧464.0kg的
,现煅烧464.0kg的 ,得到316.8kg产品,若产品中杂质只有
,得到316.8kg产品,若产品中杂质只有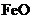 ,则该产品中
,则该产品中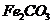 的质量是
kg(摩尔质量/g·
的质量是
kg(摩尔质量/g·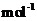 ;
;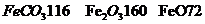 )
)
25.(16分)
丙烯可用于合成是杀除根瘤线虫的农药(分子式为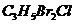 )和应用广泛的DAP树脂;
)和应用广泛的DAP树脂;
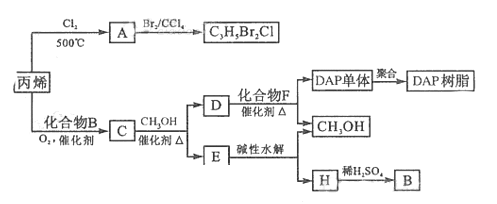
已知脂与酯克发生如下酯交换反应:
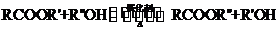 (R,R’ R’’代表羟基)
(R,R’ R’’代表羟基)
(1)农药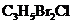 分子中每个碳原子上均连有卤原子。
分子中每个碳原子上均连有卤原子。
①A的结构简式是
A 含有的官能团名称是 ;
②由丙烯生成A的反应类型是
(2)A水解可得到D,该水解反应的化学方程式是 。
(3)C蒸汽密度是相同状态下甲烷密度的6.25倍,C中各元素的质量分数分别为
碳60%,氢8%,氧32% ,C的结构简式是 。
(4)下列说法正确的是(选填序号字母)
a.能发生聚合反应,还原反映和氧化反映
b.C含有两个甲基的羟酸类同分异构体有4个
c D催化加氢的产物与B具有相同的相对分子质量
d E有芳香气味,易溶于乙醇
(5)E的水解产物经分离子最终的到甲醇和B,二者均可循环利用DAP树脂的制备。其中将甲醇与H分离的操作方法是
(6)F的分子式为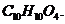 DAP单体为苯的二元取代物,且两个取代基部处于对位,
DAP单体为苯的二元取代物,且两个取代基部处于对位,
该单体苯环上的一溴取代物只有两种。D和F反应生成DAP单体的化学方程式
。
12. 由短周期元素组成的中学常见无机物A、B、C、D、E、X
存在如在右图转化关系(部分生成物和反应条件略去)
下列推断不正确的是
A.若X是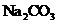 ,C为含极性键的非极性分子,则A一定是氯气,且D和E不反应
,C为含极性键的非极性分子,则A一定是氯气,且D和E不反应
B.若A是单质,B和D的反应是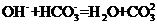 ,则E一定能还原
,则E一定能还原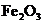
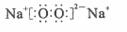 C.若D为CO,C能和E反应,则A一定为
C.若D为CO,C能和E反应,则A一定为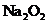 ,其电子式是
,其电子式是
D.若D为白色沉淀,与A摩尔质量相等,则X一定是铝盐
11.有4中混合溶液,分别由等体积0.1mol/L的2种溶液混合面成:①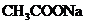 与
与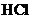 ;
;
②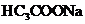 与
与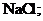 ③
③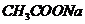 与
与 ④
④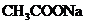 与
与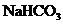
下列各项排序正确的是
A.pH:②>③>④>①
B 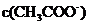 :②>④>③>①
:②>④>③>①
 C.溶液中:①>③>②>④ D
C.溶液中:①>③>②>④ D 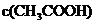 :①>④>③>②
:①>④>③>②
10. 甲、乙、丙、丁4中物质分别含2种或3种元素,它们的分子中各含18个电子。甲是
气态氢化物,在水中分步电离出两种阴离子。下列推断合理的是
A.某拿酸溶液含甲电离出的阴离子,则该溶液显碱性,只能与酸反应
B.乙与氧气的摩尔质量相同,则乙一定含有极性键和非极性键
C.丙中含有2周期IVA族的元素,则丙一定是甲烷的同系物
D.丁和甲中各元素质量比相同,则丁中一定含有-1价的元素
9.已知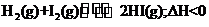 有相同容积的定容密封容器甲和乙,甲中加
有相同容积的定容密封容器甲和乙,甲中加
入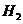 和
和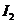 各0.1mol ,乙中加入HI 0.2mol,相同温度下分别达到平衡。欲使甲中HI的
各0.1mol ,乙中加入HI 0.2mol,相同温度下分别达到平衡。欲使甲中HI的
平衡浓度大于乙中HI的平衡浓度,应采取的措施是
A.甲、乙提高相同温度 B 甲中加入0.1mol He,乙不改变
C.甲降低温度,乙不变 D 甲增加0.1mol 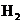 ,乙增加0.1mol
,乙增加0.1mol 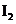
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com