
13.(08江苏卷)工业上制备BaCl2的工艺流程图如下:
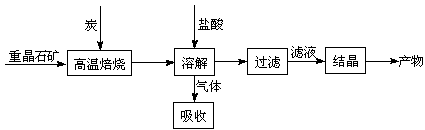
某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验。查表得
BaSO4(s) + 4C(s) 4CO(g) + BaS(s) △H1 =
571.2 kJ·mol-1 ①
4CO(g) + BaS(s) △H1 =
571.2 kJ·mol-1 ①
BaSO4(s) + 2C(s) 2CO2(g) + BaS(s) △H2=
226.2 kJ·mol-1 ②
2CO2(g) + BaS(s) △H2=
226.2 kJ·mol-1 ②
⑴气体用过量NaOH溶液吸收,得到硫化钠。Na2S水解的离子方程式为 。
⑵向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,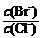 =
。
=
。
[Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
⑶反应C(s) + CO2(g) 2CO(g)的△H2= kJ·mol-1。
2CO(g)的△H2= kJ·mol-1。
⑷实际生产中必须加入过量的炭,同时还要通入空气,其目的是
, 。
12.(07广东卷) 羟基磷灰石[Ca5(PO4)3OH]是一种重要的生物无机材料,其常用的制备方法有两种:
方法A:用浓氨水分别调Ca(NO3)2和(NH4)2HPO4溶液的pH约为12;在剧烈搅拌下,将(NH4)2HPO4溶液缓慢滴入Ca(NO3)2溶液中。
方法B:剧烈搅拌下,将H3PO4溶液缓慢滴加到Ca(OH)2悬浊液中。
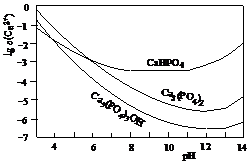
3种钙盐的溶解度随溶液pH的变化如上图所示(图中纵坐标是钙离子浓度的对数),回答下列问题:
(1)完成方法A和方法B中制备Ca5(PO4)3OH的化学反应方程式:
①5Ca(NO3)2+3(NH4)2HPO4+4NH3·H2O=Ca5(PO4)3OH↓+__________+_________
②5Ca(OH)2+3H3PO4=_________________________________________
(2)与方法A相比,方法B的优点是__________________________________________。
(3)方法B中,如果H3PO4溶液滴加过快,制得的产物不纯,其原因是________________________________________。
(4)图中所示3种钙盐在人体中最稳定的存在形式是______________________(填化学式)。
(5)糖黏附在牙齿上,在酶的作用下产生酸性物质,易造成龋齿。结合化学平衡移动原理,分析其原因________________
__________________________________________________。
11.(07江苏卷)实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:
4NH4+ +6HCHO =3H++6H2O+(CH2)6N4H+ [滴定时,1 mol (CH2)6N4H+与 l mol H+相当],然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行了如下实验:
步骤I 称取样品1.500 g。
步骤II 将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤III 移取25.00 mL样品溶液于250 mL锥形瓶中,加入10 mL 20%的中性甲醛溶液,摇匀、静置5 min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次。
(1)根据步骤III 填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数________(填“偏高”、“偏低”或“无影响”)。
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积__________(填“偏大”、“偏小”或“无影响”)
③滴定时边滴边摇动锥形瓶,眼睛应观察____________
(A)滴定管内液面的变化 (B)锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由_________色变成_________色。
(2)滴定结果如下表所示:
|
滴定 次数 |
待测溶液的体积 /mL |
标准溶液的体积/mL |
|
|
滴定前刻度 |
滴定后刻度 |
||
|
1 |
25.00 |
1.02 |
21.03 |
|
2 |
25.00 |
2.00 |
21.99 |
|
3 |
25.00 |
0.20 |
20.20 |
若NaOH标准溶液的浓度为0.1010 mol·L-1,则该样品中氮的质量分数为___________。
10.(01全国卷)将 a g 含NaOH样品溶解在 b mL 0.l mol·L-1 的硫酸中,再加入 c mL 0.1 mol·L-1 的氢氧化钡溶液,反应后所得溶液恰好呈中性,则样品中NaOH的纯度是( )
A.[(b-c)/125a]×100% B.[(b-2c)/125a]×100%
C.[(b-c)/250a]×100% D.[(8b-8c)/a]×100%
9.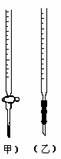 (01全国卷)用已知浓度的NaOH溶液测定某H2SO4溶液的浓度,参考下图,从下表中正确的实验是( )
(01全国卷)用已知浓度的NaOH溶液测定某H2SO4溶液的浓度,参考下图,从下表中正确的实验是( )
|
|
锥形瓶中溶液 |
滴定管中溶液 |
选用指示剂 |
选用滴定管 |
|
A |
碱 |
酸 |
石蕊 |
(乙) |
|
B |
酸 |
碱 |
酚酞 |
(甲) |
|
C |
碱 |
酸 |
甲基橙 |
(甲) |
|
D |
酸 |
碱 |
酚酞 |
(乙) |
8.(01全国卷)在一支25 mL的酸式滴定管中盛入0.lmol·L-1 HCl溶液,其液面恰好在5 mL的刻度处,若把滴定管中的溶液全部放入烧杯中,然后以0.lmol·L-1 NaOH 溶液进行中和.则所需 NaOH 溶液的体积( )
A.大于20 mL B.小于20 mL C.等于20 mL D.等于5 mL
7.(06上海卷)室温下,下列溶液等体积混合后,所得溶液的pH一定大于7的是( )
A.0.1mol/L的盐酸和0.1mol/L的氢氧化钠溶液
B.0.1mol/L的盐酸和0.1mol/L的氢氧化钡溶液
C.pH=4的醋酸溶液和pH=10的氢氧化钠溶液
D.pH=4的盐酸和pH=l0的氨水
6.(06北京卷)某酸HX稀溶液和某碱YOH稀溶液的物质的量浓度相等,两溶液混合后,溶液的pH大于7。下表中判断合理的是( )
|
编号 |
HX |
YOH |
溶液的体积关系 |
|
① |
强酸 |
强碱 |
V(HX)=V(YOH) |
|
② |
强酸 |
强碱 |
V(HX)<V(YOH) |
|
③ |
强酸 |
弱碱 |
V(HX)=V(YOH) |
|
④ |
弱酸 |
强碱 |
V(HX)=V(YOH) |
A.①③ B.②③ C.①④ D.②④
5.(08山东卷)某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )

提示:BaSO4(s)=Ba2+(aq)+SO2-4(aq)的平衡
常数Kap=c(Ba2+)·c(SO2-4),称为溶度积常数。
A.加入Na2SO4可以使溶液由a点变到b点
B.通过蒸发可以使溶液由d点变到c点
C.d点无BaSO4沉淀生成
D.a点对应的Kap大于c点对应的Kap
4.(07天津卷)草酸是二元中弱酸,草酸氢钠溶液显酸性。常温下,向10 mL 0.01 mol·L-1 NaHC2O4溶液中滴加0.01 mol·L-1 NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是 ( )
A.V(NaOH) = 0时,c(H+) = 1×10-2 mol·L-1
B.V(NaOH)<10 mL时,不可能存在c(Na+) = 2c(C2O42 -)+c(HC2O4- )
C.V(NaOH) = 10 mL时,c(H+) = 1×10-7 mol·L-1
D.V(NaOH)>10 mL时,c(Na+)>c(C2O42 -)>c(HC2O4- )
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com