
21.[南昌市高三化学综合能力检测题09.2]已知在粗碘中含ICl和IBr,受热时ICl、IBr均可升华;若在粗碘中加入一种物质再进行升华,则可制得精碘。在下列物质中,应加入的物质是( C )。
A.H2O B.Zn C.KI D.NaCl
20.[甘肃省兰州一中2008-200高三上学期第三次月考.12]向100mLFeBr2溶液中通入标准状况下的C123.36L,C12全部被还原,测得溶液中c(Br-)=c(C1-),则原FeBr2溶液的物质的量浓度是 ( B )
A.0.75mol/L B.1.5mol/L C.2 mol/ L D.3 mol/ L
19.[重庆市瑞山中学2009届高三年级第四次考试化学.15]反应⑴是自海藻灰中提取碘的主要反应,反应⑵是自智利硝石中提取碘的主要反应:
2NaI+MnO2+3H2SO4=2NaHSO4+MnSO4+2H2O+I2 …………⑴
2NaIO3+5NaHSO3=2Na2SO4+3NaHSO4+H2O+I2 …………⑵
下列有关说法正确的是 ( AC )
A.NaI 和NaIO3在一定条件下能反应生成I2
B.I2在反应⑴中是还原产物,在反应⑵中是氧化产物
C.⑴⑵两个反应中生成等量的I2时转移的电子数为1:5
D.氧化性:MnO2>IO3->I2>SO42->Mn2+
18.[重庆市瑞山中学2009届高三年级第四次考试化学.13]将NaClO3和Na2SO3按2∶1的物质的量之混合于烧瓶中,再滴入适量硫酸,并用水浴加热,产生棕黄色的气体X,反应后测得NaClO3和Na2SO3恰好完全反应,则X为 ( C )
A.Cl2 B.Cl2O C.ClO2 D.Cl2O3
17.[重庆市高2009级学生学业质量调研抽理综.29](15分)在室温下,向200mLCu(IO3)2饱和溶液中加入一定浓度100mL(经酸化)的KI溶液,发生如下反应:
5I- + IO3- + 6H+ = 3I2 + 3H2O
2Cu2+ + 4I- = 2CuI↓+ I2
充分反应后,再加入25.0mL 0.234mol/LKIO3溶液恰好将过量的KI反应掉。再从上述所得混合液中取出25.0mL,用0.110mol/LNa2S2O3溶液滴定,发生反应
I2 + 2S2O32- = 2I- + S4O62-
消耗了30.0mLNa2S2O3溶液。溶液体积改变忽略不计。计算:
(1)原饱和溶液中Cu(IO3)2的物质的量浓度;
(2)若Cu(IO3)2饱和溶液的的密度为1.00g/cm3,Cu(IO3)2的溶解度是多少?
答案(1)混合液中总碘 (3分)
(3分)
KIO3与KI反应生成的碘:n1(I2)=25.0×10-3L×0.234mol/L×3=0.0176mol……(3分)
根据上述反应式可知:1molCu(IO3)2与KI完全反应可生成6.5molI2
故: …………(3分)
…………(3分)
C[Cu(IO3)2]=0.000600mol÷0.200L=0.00300mol/L …………………………………(2分)
(2) Cu(IO3)2溶解度: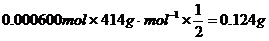 ………………(4分)
………………(4分)
16.[天津市汉沽一中2008-2009学年度高三第四次月化学.17]“XYn”表示不同卤素之间靠共用电子对形成的卤素互化物 (非金属性:X<Y), 其化学性质和卤素单质相似。下列说法中,正确的是[BC]
A.ICl与水反应可生成 HCl 和 HIO,则1mol ICI 参加反应转移电子为 1mol
B.某温度,液态 IF5电离:2IF5≒ IF4+ +IF6-, 则 c (IF4+)×c (IF6-) 是一个常数
C.BrCl与 Zn 反应生成 ZnCl2 和 ZnBr2
D.XYn 与卤素单质一样都是非极性分子
15.[天津市汉沽一中2009第五次月考化学.23]2004年7月30日,位于秦皇岛海港区涂庄的一化学试剂厂,发生氯气泄露事故,泄露出的氯气迅速向周围的居民区蔓延,所到之处草木枯黄、大片蔬菜被毁。请回答下列问题:
(1)如果你当时在现场,你应该往哪里撤离?(山坡上/低洼处)
(2)如果你在该厂实验室准备撤离时,应该准备什么样的简易“防毒面具”避免吸入较多的氯气?
(3)如果你当时在距离化工厂较近的居民家中,如何利用家中现成物质来制作简易“防毒面具”?
(4)消防官兵赶到现场处理,他们先把泄露的氯气钢瓶投入一盛有某物质水溶液的水缸中,该物质是
(5)对于弥漫在空气中没有散去的氯气,消防队员喷洒了一种挥发性化学物质水溶液进行处理,该化学物质是
答案.(1)山坡上;(2)碳酸钠溶液或碳酸氢钠溶液浸湿毛巾;
(3)肥皂水(或洗衣粉)浸湿毛巾;
(4)氢氧化钠溶液或者氢氧化钙溶液;
(5)浓氨水。(2分×5)[其它合理答案也可]
在圆底烧瓶底部,有一用塑料网包住的过量块状碳酸钙和150mL饱和氯水,按如图所示装置实验,待不再产生气泡后,将塑料网中剩余的石灰石提出液面,密封后再加热、煮沸烧瓶中的液体,直到量筒中的气体不再增加。

请回答:
(3)为减少用装置Ⅲ收集气体过程中CO2因溶解而造成的损失,请你对装置Ⅲ进行改进,其方法可以是(写出一种即可)
(4)用改进后的装置进行上述实验,测得塑料网内的碳酸钙质量减少Ag,总共收集到标准状况下的CO2气体BL,发现 明显小于
明显小于 。若不考虑实验操作和CO2的溶解等因素造成的误差,从化学反应原理来看,导致这一大小关系的原因是____________ ;
。若不考虑实验操作和CO2的溶解等因素造成的误差,从化学反应原理来看,导致这一大小关系的原因是____________ ;
(5)实验后发现,装置Ⅱ中的液体增多了,其原因是_______________ ____。
答案.(1)CaCO3消耗了氯水中的HCl,使Cl2+H2O HCl+HClO平衡向右移动,HClO浓度增大
HCl+HClO平衡向右移动,HClO浓度增大
(2)Ca(HCO3)2(写名称正确同样得分)
(3)在导管末端再连接长导管,使导管的出口接近量筒底部(将水换成NaHCO3溶液)
(4)碳酸钙与氯水反应生成的Ca(HCO3)2再受热时,除生成CO2外,还生成了CaCO3
(5) 从圆底烧瓶蒸出的水蒸气在广口瓶中冷凝、聚集
14.[天津市汉沽一中2009第五次月考化学.8]两瓶气体分别为NO2和Br2蒸气,外观均相同,某同学设计了各种鉴别法,①用湿润的淀粉KI试纸②加少量NaCl溶液③加少量AgNO3溶液④加少量水后再加适量苯⑤一定条件下改变温度 ( C )
A.只能采用①③④ B.只能采用②③④
C.能采用②③④⑤ D.都可以
① 在试管中加入过量的块状碳酸钙,再加入约20mL饱和氯水,充分反应,
 有少量气泡产生,溶液浅黄绿色褪去;
有少量气泡产生,溶液浅黄绿色褪去;
②过滤,将滤液滴在有色布条上,发现其比氯水的漂白性更强;
③为了确定反应产物,将滤液分为三份,分别进行以下实验:
第一份与石灰水混合,立即产生大量白色沉淀;
第二份与稀盐酸混合,立即产生大量无色气体;
将第三份加热,看到溶液变浑浊且有大量无色气体产生。
经检测,上述实验中产生的无色气体均为CO2。
请回答:
(1)反应后所得的溶液漂白性增强的原因是_____________________ ;
(2)依据上述实验可推知,②的滤液中的溶质除CaCl2、HCIO外,还含有______________;
25.[桂林市十八中06级高三第2次月考.5]将V1 mL 1.0 mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50 mL)。下列叙述正确的是[B]
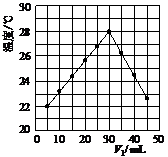
A.做该实验时环境温度为22 ℃
B.该实验表明化学能可以转化为热能
C.NaOH溶液的浓度约是1.00 mol/L
D.该实验表明有水生成的反应都是放热反应
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com