
14.(9分)元素周期表前20号元素中,某两种元素的原子序数相差3,周期数相差1。
(1)这样的两种元素的组合有________种。
(2)若这样的两种元素形成化合物时原子数之比为1∶2,
①写出这些化合物的化学式:________________________________________________________________________;
②在这些化合物中存在的化学键是________(填“离子键”或“共价键”);
(3)若这样的两种元素形成的化合物中有两种的原子数之比为1∶1。
①写出这两种化合物的化学式和名称:________________________________________________________________________;
②在这两种化合物中存在的化学键是__________________(填“离子键”或“共价键”);
③这两种化合物属于__________(填“离子化合物”或“共价化合物”)。
[解析] (1)设这两种元素分别是M和N,且原子序数M<N,两种元素在元素周期表中的位置关系是:

即这两种元素的组合有7种:①H和Be;②He和B;③O和Na;④F和Mg;⑤Ne和Al;⑥S和K;⑦Cl和Ca。
(2)这样的两种元素的组合只能是③④⑥⑦,它们相互化合时形成的化学键是离子键。
(3)这样的两种元素形成的化合物中有两种的原子数之比为1∶1,对其熟知的是Na2O2,再结合同族元素性质相似的原理进行分析可知,另一种这样的化合物是K2S2。它们都是离子化合物。
[答案] (1)7
(2)①Na2O、K2S、MgF2、CaCl2;②离子键
(3)①Na2O2、过氧化钠 K2S2、过硫化钾 ②离子键、共价键
③离子化合物
13.(12分)下表列出了A-R九种元素在周期表中的位置:
|
主族 |
|
|
|
|
|
|
|
|
|
周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
|
二 |
|
|
E |
|
|
F |
|
|
|
三 |
A |
C |
D |
|
|
|
G |
R |
|
四 |
B |
|
|
|
|
|
H |
|
(1)D、E、R的元素符号分别为________、________、________,其中化学性质最不活泼的是________。
(2)G、H两种元素的最高价氧化物对应的水化物中,酸性最强的是________。
(3)A、B、C三种元素按原子半径由大到小的顺序排列为__________。
(4)F元素氢化物的化学式是________,该氢化物在常温下跟B发生反应的化学方程式是________________________________________________________________________。
(5)A、G两种元素的最高价氧化物对应的水化物发生反应的化学方程式是________________________________。
(6)G元素和H元素、A元素和B元素原子的核电荷数之差分别是____________。
[答案] (1)Al B Ar Ar
(2)HClO4 (3)K、Na、Mg (4)H2O
2K+2H2O===2KOH+O2↑
(5)NaOH+HClO4===NaClO4+H2O
(6)18、8
12.

如右图所示是元素周期表的一部分,关于元素X、Y、Z的叙述正确的是( )
①X的气态氢化物与Y的最高价氧化物对应的水化物能发生反应生成盐 ②Y、Z的气态氢化物的水溶液的酸性:Y<Z
③Z的单质在常温下是液体,可与铁粉反应 ④Z的原子序数比Y大19 ⑤Z所在的周期中含有32种元素
A.①②③④ B.①②③④⑤
C.只有③ D.①④
[解析] 从题中各元素在周期表中所处的位置,得出该图为元素周期表右上角的一部分,由此可以依次判断出各元素:R为He,X为N,Y为S,Z为Br。X的气态氢化物为NH3,而Y的最高价氧化物对应的水化物为H2SO4,它们可反应生成硫酸铵,①正确;Y、Z的气态氢化物分别为H2S、HBr,HBr的水溶液为强酸,H2S的水溶液为弱酸,故②正确;说法③符合客观事实,正确;Z的原子序数为35,而Y的原子序数为16,④正确;Z所在周期为第四周期,从19号元素开始,到36号元素结束,共18种元素,⑤错误。综上所述,正确的答案为A。
[答案] A
11.砷为第四周期VA族元素,根据它在周期表中的位置推测,砷不可能具有的性质是( )
A.砷在通常状况下是固体
B.可以有-3、+3、+5等多种化合价
C.As2O5对应水化物酸性比H3PO4弱
D.砷的还原性比磷弱
[解析] 砷为第四周期ⅤA族元素,第ⅤA族元素最外层有5个电子,可以失去5个电子而呈+5价,也可以得到3个电子而呈-3价,而ⅤA族的N、P除有-3、+5价外,还有+3价;砷在周期表中位于磷的下一周期,磷为固体,可推知砷也为固体;同主族从上到下,最高价氧化物对应水化物的酸性逐渐减弱。故A、B、C项性质可能具有。同主族从上到下元素单质的还原性增强,砷的还原性比磷强。
[答案] D
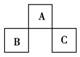
10.如图是元素周期表中短周期的一部分,B原子与C原子核外电子数之和是A的4倍,则下列推断正确的是( )
A.A、B、C三者均为非金属元素
B.A、B、C三者可以共同形成一种离子化合物
C.A、B、C三者核电荷数之和为32
D.B的氢化物比C的氢化物稳定
[解析] 设A的原子序数为x,则B为x+7,C为x+9。依题意:x+7+x+9=4x,x=8,A、B、C分别是O、P、Cl,三者均为非金属元素,A对;三者之间只能形成共价键,不可能形成一种离子化合物,B错;三者核电荷数之和为8+15+17=40,C错;非金属性C>B,因此氢化物的稳定性C>B,D错。
[答案] A
9.根据化学反应的实质是旧键断裂新键形成这一事实,下列变化不属于化学反应的是( )
A.白磷在260 ℃时转化为红磷
B.石墨在高温下转化为金刚石
C.NaCl熔化
D.五氧化二磷吸水
[解析] NaCl熔化时只有离子键的断裂,故不属于化学变化;而同素异形体间的转化、P2O5吸水生成H3PO4,均有旧化学键的断裂和新化学键的形成,故A、B、D项中的过程均属于化学变化。
[答案] C
8.(2010年漳州质检)根据下表信息,判断以下叙述正确的是( )
部分短周期元素的原子半径及主要化合价
|
元素代号 |
L |
M |
Q |
R |
T |
|
原子半径/nm |
0.160 |
0.143 |
0.112 |
0.104 |
0.061 |
|
主要化合价 |
+2 |
+3 |
+2 |
+6、-2 |
-2 |
A.氢化物的沸点为H2T<H2R
B.单质与稀盐酸反应的速率为L<Q
C.M与T形成的化合物具有两性
D.L2+与R2-的核外电子数相等
[解析] 由主要化合价为+2价知,L、Q为第ⅡA族元素,又r(L)>r(Q),所以L为Mg元素,Q为Be元素;由主要化合价+3价及r(L)>r(M)>r(Q)知,M与L同周期且为第ⅢA族Al元素;由主要化合价为+6、-2价知,R为ⅥA族元素,又r(Q)>r(R)知,R为第三周期硫元素;由主要化合价为-2价,r(T)<r(R)知,T为第二周期第ⅥA族氧元素。A项中由于水分子间存在氢键,氢化物的沸点H2T>H2R(H2O>H2S),故A错误;B项中单质与盐酸反应速率,Mg>Be,故B项错误;C项中三氧化二铝是两性氧化物,故C正确;D项中Mg2+与S2-电子数不等,故D错误。
[答案] C
7.最新研究表明生命起源于火山爆发,因为火山爆发产生的气体中含有1%的羰基硫(化学式为COS, 就是羰基),已知羰基硫分子中所有原子最外层均满足8电子稳定结构,结合元素周期表知识,下列有关说法正确的是( )
就是羰基),已知羰基硫分子中所有原子最外层均满足8电子稳定结构,结合元素周期表知识,下列有关说法正确的是( )
A.羰基硫中O为-2价,C、S都是+1价
B.羰基硫分子中共含有3个原子核、16个电子
C.羰基硫的电子式为: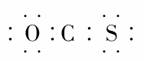
D.羰基硫分子结构中只含有极性共价键
[解析] 根据题中所提供的信息,我们可以逐项进行分析、判断。选项C:由电子式可看出碳原子未满足8电子稳定结构,故此选项错误,结合题意及提示内容可知正确的电子式应为:··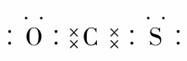 ,这表明羰基硫的结构与二氧化碳是相似的,其实就是CO2中的一个O原子被一个S原子代替。根据正确的电子式可知羰基硫分子结构中,
,这表明羰基硫的结构与二氧化碳是相似的,其实就是CO2中的一个O原子被一个S原子代替。根据正确的电子式可知羰基硫分子结构中,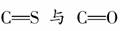 均是极性共价键,故选项D正确;B选项:羰基硫分子中有3个原子核,共有30(6+8+16)个电子,所以选项B错误;选项A:根据电子式可知C为+4价,O、S都是-2价,故选项A错误。
均是极性共价键,故选项D正确;B选项:羰基硫分子中有3个原子核,共有30(6+8+16)个电子,所以选项B错误;选项A:根据电子式可知C为+4价,O、S都是-2价,故选项A错误。
[答案] D
6.下列关于化学键的叙述正确的是( )
A.构成单质分子的粒子一定含有共价键
B.由非金属元素组成的化合物不一定是共价化合物
C.非极性键只存在于双原子分子的单质里
D.不同元素组成的多原子分子里的化学键一定是极性键
[解析] 稀有气体的单质是单原子分子,不含共价键,故A项错;NH4Cl、NH4HCO3等都是由非金属元素组成的离子化合物,故B项对;Na2O2、H2O2等分子中存在着非极性键,故C项错;H2O2、CH3-CH3分子里的O-O键、C-C键是非极性键,故D项错。
[答案] B
5.下列各数值表示有关元素的原子序数,各原子组能以离子键相互结合形成稳定化合物的是( )
A.10与19 B.6与16
C.11与17 D.14与8
[解析] 离子键的形成一般是金属元素和非金属元素之间才能形成。A项是Ne和K,Ne一般不参与形成化合物;B项是C和S,只能形成共价化合物;C项是Na和Cl,形成的NaCl是典型的离子化合物;D项是Si和O,形成的SiO2是共价化合物。
[答案] C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com