
2.等可能事件的概率(古典概率): P(A)=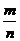 。理解这里m、n的意义。如(1)将数字1、2、3、4填入编号为1、2、3、4的四个方格中,每格填一个数字,则每个方格的标号与所填数字均不相同的概率是______(答:
。理解这里m、n的意义。如(1)将数字1、2、3、4填入编号为1、2、3、4的四个方格中,每格填一个数字,则每个方格的标号与所填数字均不相同的概率是______(答: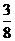 );(2)设10件产品中有4件次品,6件正品,求下列事件的概率:①从中任取2件都是次品;②从中任取5件恰有2件次品;③从中有放回地任取3件至少有2件次品;④从中依次取5件恰有2件次品。(答:①
);(2)设10件产品中有4件次品,6件正品,求下列事件的概率:①从中任取2件都是次品;②从中任取5件恰有2件次品;③从中有放回地任取3件至少有2件次品;④从中依次取5件恰有2件次品。(答:①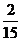 ;②
;②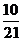 ;③
;③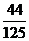 ;④
;④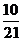 )
) 
1.随机事件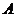 的概率
的概率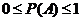 ,其中当
,其中当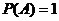 时称为必然事件;当
时称为必然事件;当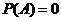 时称为不可能事件P(A)=0;
时称为不可能事件P(A)=0; 
6.将VLNO和NO2的混合气体通过水吸收后,得到amL无色气体A。将此无色气体A与等体积O2混合,再通过水充分吸收后,收集到5mL无色气体B。试回答:
(1)A气体是__________________,B气体是_________________________。
(2)A气体的体积是______________________mL
(3)V值的取值范围是____________________。
答案:(1)A是NO;B是O2。(2)20mL。(3)20<V<60。
5.下列关于砷(As)元素的叙述中,正确的是( )。
(A)在AsCl3分子中,砷原子最外层电子数为8
(B)砷的相对原子质量为74.92,由此可知砷原子核内有42个中子
(C)砷的氢化物的化学式为AsH3,它是一种强氧化剂
(D)砷酸(H3AsO4)是强酸,其酸性与硫酸相似
答案:A。
4.在一定温度和压强下,将装有N2和NO2混合气体的试管倒立于水槽中,最后试管内气体的体积缩小为原体积的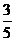 ,则混合气体中N2与NO2的体积比是( )。
,则混合气体中N2与NO2的体积比是( )。
(A)2:3 (B)3:2 (C)3:5 (D)5:3
答案:A。
3.在城市空气中含有浓度较大的一氧化碳、氮的氧化物等大气污染物,这些污染物的主要来源是( )。
(A)硫酸工业排放的废气 (B)氨氧化法制硝酸中吸收塔排放的废气
(C)汽车尾气 (D)煤炭不完全燃烧产生的废气
答案:C。
2.关于磷的下列叙述中,正确的是( )
(A)红磷没有毒性而白磷有剧毒 (B)白磷在空气中加热到260℃可转变为红磷
(C)白磷可用于制造安全火柴 (D)少量白磷应保存在水中
答案:AD。
3.一氧化氮、氧气同时跟水反应:4NO+3O2+H2O = 4HNO3
遇到这类计算题时,首先要弄清所涉及的反应原理是哪种情况,再进行计算。如,二氧化氮跟氧气的混合气体溶于水时,可能有以下向种情况:
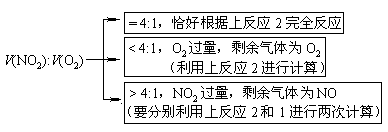
[例题讲解]
[例1]将盛有氮气和二氧化氮混合气体的试管倒立于水中,经过足够时间后,试管内气体体积缩小为原体积的一半,则原混合气体中氮气和二氧化氮的体积比是 。
[分析]氮气跟水不反应,所以可根据“3NO2+H2O=2HNO3+NO”用体积差法进行计算。
答案为:1:3。
[例2]
将容积为50mL的量筒内充满NO2和O2的混合气体,倒置量筒在盛满水的水槽里,足够时间后,量筒里剩余气体体积为5mL。则混合气体中NO2和O2体积比可能是 。
[分析]二氧化氮、氧气混合气体例置于水中,最后残留气体可能有二种情况,一是氧气,二是一氧化氮。所以应先假设,再立式计算。
[解答](1)若剩余的5mL气体是O2,则共有45mLNO2、O2混合气体跟水反应,根据4NO2+O2+H2O = 4HNO3可得出:
V(NO2)=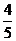 ×45mL=36mL
×45mL=36mL
V(O2)=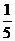 ×45mL+5mL=14mL
×45mL+5mL=14mL
所以,原混合气体中NO2和O2体积比为18:7。
(2)若剩余的5mL气体是NO,则NO2、O2混合气体跟水反应时是NO2过量,过量的NO2再跟水反应。根据反应“3NO2+H2O=2HNO3+NO”可得出,共有15mLNO2过量。
即,在NO2、O2混合气体跟水反应的过程中共消耗气体35mL。根据4NO2+O2+H2O = 4HNO3可得出:
V(O2)=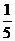 ×35mL=7mL
×35mL=7mL
V(NO2)=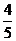 ×35mL+15mL= 43mL
×35mL+15mL= 43mL
所以,原混合气体中NO2和O2体积比为43:7。
2.二氧化氮、氧气同时跟水反应:4NO2+O2+H2O = 4HNO3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com