
8、(1)Cu+4HNO3(浓)== Cu(NO3)2+2NO2↑+2H2O
(2) ①检查装置的气密性 ②没有尾气处理装置,过量的NO2逸出后将导致空气污染。
(或:不能随时控制反应的开始和停止,浪费药品,且过量的NO2逸出后将导致空气污染)
(3)试管内液面上升到约为试管体积的2/3,气体由棕红色变为无色。
3NO2+H2O==2HNO3+NO
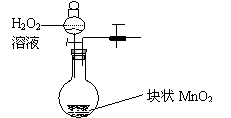 (4)
(4)
①
② O2通入的速度过快,导致试管内迅速充满了O2。
7、(1)将导管的出口浸入水槽的水中,手握住试管,有气泡从导管口逸出,放开手后,有少量水进入导管,表明装置不漏气。
(2)②①③
(3)慢慢将量筒下降
(4)取下试管A,向其中加入少量水,再沿试管慢慢加入少量浓硫酸,振荡,使液体总体积不超过试管容积的1/3,将试管斜放,把锌片放在试管内壁上,塞紧塞子,慢慢直立,使锌片滑下与稀硫酸接触。
固定A、甲、乙三管,在乙管内注入适量水,将A、甲两管橡皮塞塞紧,上下移乙管,使乙管液面高于甲管液面,,静置片刻后,水面保持不变,说明装置气密性好。
(5)①关闭弹簧夹时,反应产生的气体使试管内液面上的压力增加,所以液面下降。
②塞紧橡皮寨,夹紧弹簧夹后,从漏斗注入一定量的水,使漏斗内的水面高于试管内的水面,停止加水后,漏斗中与试管中的液面差保持不再变化,说明装置不漏气。
6、
|
组合编号 |
A、B中的液体 |
A中的固体 |
B中的固体 |
产生的气体 |
|
① |
稀盐酸(或稀硫酸) |
镁粉 |
铁粉 |
H2 |
|
② |
稀盐酸(或稀硫酸) |
NaHCO3 |
Na2CO3 |
CO2 |
|
③ |
稀盐酸(或稀硫酸) |
Na2S |
FeS |
H2S |
|
④ |
稀硝酸 |
铁粉 |
铜粉 |
NO |
5、 (1)装置的连接顺序是:(a)接( f ) ( e )接( d ); (b)接( c )
(2) 碳酸钙 ; 饱和碳酸氢钠; NH3.H2O + CaO ==NH3 +Ca(OH)2
(3) B
(4) 防止倒吸 NH3 + CO2 + H2O +NaCl =NH4Cl +NaHCO3 ↓
例1、 D
例2、(1)H2、NH3的密度比空气小,而O2的密度比空气大。
(2)把装置Ⅱ中的进气导管改为长导管插到试管底部,出气导管管口应与胶塞相平
3%的H2O2溶液、少量的MnO2粉末
(3)排水法收集--广口瓶中盛满水 , NO 从 d 管通入
利用排CO2集气法收集--广口瓶中先收集满 CO2 气体 , 然后将NO 从 d 管通入。
 (4)(5)浓盐酸、KMnO4、NaBr溶液、溶液由无色变橙色
(4)(5)浓盐酸、KMnO4、NaBr溶液、溶液由无色变橙色
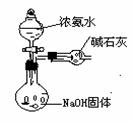 例3、
例3、
i. 打开K1、K2,从K2处通入干燥的HCl气体,直 到K1处有白雾出现,关闭K1、K2。
②生成大量的白烟。 B管中充满石蜡油。
实验时A管中未全部充满干燥HCl气体
例4、①BaCl2和NaCl 不能 ②D D中不仅含有NaCl,还有Na2CO3
③过量NaOH溶液 Mg(OH)2 Na2SO4(NaOH) A、C
课堂练习
1、C 2、D 3、BD 4、D
9、硫酸铜的制备实验是无机化学实验教学中一个必做实验,某研究性学习小组设计了如下两个实验方案:
实验一:
因铜不能与稀硫酸直接反应,实验中以浓硝酸分次加入到铜和稀硫酸的混合液中,加热使之完全反应,通过蒸发、析晶等操作得到硫酸铜晶体。
(1)浓硝酸所起的作用是___________________________________
(2)该反应的原理是(用化学方程式表示)
______________________________________________ 。
实验二:
以空气为氧化剂的一步氧化法,将空气或氧气直接通入到铜粉与稀硫酸的混合物中,其反应原理为2Cu + O2 + 2H2SO4 = 2CuSO4 + 2H2O ,但反应速率太小,当升高温度到80-90℃,反应仍然缓慢。如在铜粉和稀硫酸的混合物中加入少量Fe2(SO4)3溶液,则速率明显加快。
(3)用离子方程式表示速率明显加快的原理
______________________________________________ 。
Fe2(SO4)3的作用是__ 。
(4)得到的混合液用______________调节pH =2-4,使Fe3+形成Fe(OH)3沉淀而除去,且Fe(OH)3可以循环使用。
(5)请根据以上内容,对这两个实验方案进行评价,填下表:
|
|
实 验 一 |
实 验 二 |
|
主要优 点 |
|
|
|
主要缺 点 |
|
|
第3讲:常见物质的实验室制法(详解)
8、为了在实验室模拟用二氧化氮溶于水生成硝酸,现进行如下实验:
实验一:制备并收集一试管二氧化氮
 (1)实验室常用浓硝酸与铜反应制备二氧化氮,化学方程式是
。
(1)实验室常用浓硝酸与铜反应制备二氧化氮,化学方程式是
。
(2)可用右图装置制备并收集一试管二氧化氮,
① 在加入药品前,必须进行的操作是
 。
。
② 该装置的缺点是(只填一个缺点既可)
实验二:尽可能多地使试管中的二氧化氮被水吸收
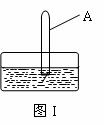
(3)将装有二氧化氮的试管A倒插入水中(图I),并轻轻晃动试管,观察到的现象是:
反应的化学方程式是 。
(4)从下图中挑选所需的仪器,完成制取O2,并将O2通入到上述实验后的试管A中。
①画出制取O2装置简图(添加必要的塞子、玻璃导管、胶皮管。固定装置不用画),并标明所用试剂。
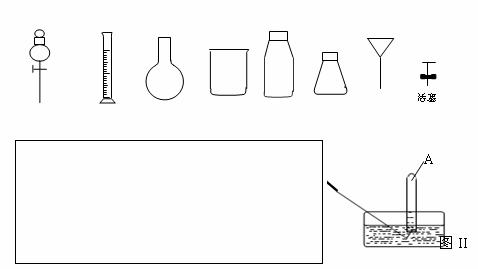
②某同学在图II的试管A内通入O2的过程中没有观察到液面上升,而是试管内充满了无色气气体,主要原因是 。
7、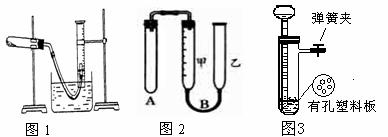
(1)如何检查上述图1装置的气密性?
。
(2)以下是测量收集到气体体积(上图1)必须包括的几个步骤;
① 调整量简内外液面高度使之相同;
②使试管和量筒内的气体都冷却至室温;
③读取量简内气体的体积。
这三步操作的正确顺序是: (请填写步骤代号)。
(3)测量收集到气体体积时,如何使量筒内外液面的高度相同?
(4)用一定质量的Zn(分片状和粒状)、浓硫酸、水以及如图2装置制取H2,要保证不漏出 H2,应如何操作
如何检查上述装置的气密性?
(5)用上图中图3的装置制取氢气,在塑料隔板上放粗锌粒,漏斗和带支管的试管中装有稀硫酸,若打开弹簧夹,则酸液由漏斗流下,试管中液面上升与锌粒接触,发生反应。产生的氢气由支管导出;若关闭弹簧夹,则试管中液面下降,漏斗中液面上升,酸液与锌粒脱离接触,反应自行停止。需要时再打开弹簧夹,又可以使氢气发生。这是一种仅适用于室温下随制随停的气体发生装置。
回答下面问题:
为什么关闭弹簧夹时试管中液面会下降?
② 这种制气装置在加入反应物前,怎样检查装置的气密性
6、右图所示的A、B两支大试管中各盛有等质量的同一种液体,试管
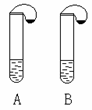 口各系有一个小气球,气球内分别装有等质量的不同固体(纯净物),
口各系有一个小气球,气球内分别装有等质量的不同固体(纯净物),
实验时将两气球抬起,将其中固体同时倾入试管内,固体全部溶解,同时看到两气球都鼓气胀大,但A试管气球胀大的速度及最终胀大的体积都明显大于B。若两试管产生同一种气体,试推测A、B中盛放的液体和固体的可能组合,将各组合填入下表,要求各组分产生的气体不能相同。(可以不填满)
|
组合编号 |
A、B中的液体 |
A中的固体 |
B中的固体 |
产生的气体 |
|
① |
|
|
|
|
|
② |
|
|
|
|
|
③ |
|
|
|
|
|
④ |
|
|
|
|
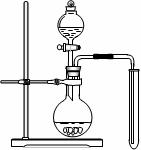
5、我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献。他利用NaHCO3、NaCl、NH4C1等物质溶解度的差异,以食盐、氨气、二氧化碳等为原料先制得NaHCO3,进而生产出纯碱。下面是在实验室中模拟“侯氏制碱法”制取NaHCO3的实验步骤:
第一步:连接好装置,检验气密性,在仪器内装入药品。
第二步:先让一装置发生反应,直到产生的气体不能再在C中溶解时,再通入另一装置中产生的气体,片刻后,C中出现固体。继续向C中通入两种气体,直到不再有固体产生。
第三步:过滤C中所得的混合物,得到NaHCO3固体。
第四步:向滤液中加入适量的NaCl粉末,有NH4C1晶体析出。
请回答下列问题:
(1)装置的连接顺序是:(a)接( ) ( )接( ); (b)接( )
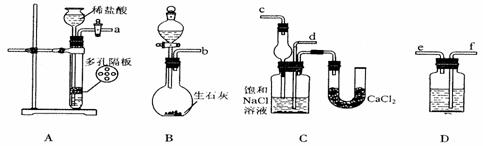
(2)A中常选用的固体反应物为 ;D中应选用的液体为 ;B中发生反应的化学方程式为 。
(3)第二步骤中必须先让 装置先发生反应。
(4)C中用球形干燥管而不用直导管,其作用是 ,
C中广口瓶内产生固体的总化学方程式为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com