
343.物质燃烧时,火焰呈紫色的一定含有 ( )
A.钾原子 B.钾元素 C.钾离子 D.钾的化合物
342.下列碱金属中密度最小,熔沸点最高的是 ( )
A.锂 B.钠 C.钾 D.铯
341.不属于碱金属元素的是 ( )
A.Li B.Na C.K D.A1
3、原子核的电荷与大小
关于原子的大小应该让学生有个数量级的概念,即原子的半径在10-10m左右,原子核的大小在10-15-10-14m左右,原子核的半径只相当于原子半径的万分之一,体积只相当于原子体积的万亿分之一。为了加深学生的印象,可举一些较形象的比喻或按比例画些示意图,同时通过表格展示,对比。
|
|
半 径 大 小 (数量级) |
类 比 |
|
原子 |
10-10m |
足球场 |
|
原子核 |
10-15m~10-14m |
一枚硬币 |
附1:教学主线设计
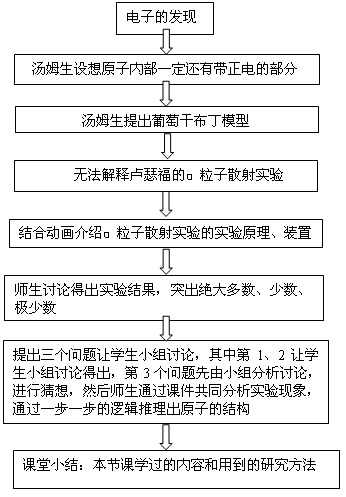
2、原子的核式结构的提出
三个问题:用汤姆生的葡萄干布丁模型能否解释 粒子大角度散射?请同学们根据以下三方面去考虑:
粒子大角度散射?请同学们根据以下三方面去考虑:
(1) 粒子出现大角度散射有没有可能是与电子碰撞后造成的?
粒子出现大角度散射有没有可能是与电子碰撞后造成的?
(2)按照葡萄干布丁模型, 粒子在原子附近或穿越原子内部后有没有可能发生大角度偏转?
粒子在原子附近或穿越原子内部后有没有可能发生大角度偏转?
(3)你认为原子中的正电荷应如何分布,才有可能造成 粒子的大角度偏转?为什么?
粒子的大角度偏转?为什么?
小结:
对于问题1、2:按照葡萄干布丁模型,①碰撞前后,质量大的 粒子速度几乎不变。只可能是电子的速度发生大的改变,因此不可能出现反弹的现象,即使是非对心碰撞,也不会有大角散射。②对于
粒子速度几乎不变。只可能是电子的速度发生大的改变,因此不可能出现反弹的现象,即使是非对心碰撞,也不会有大角散射。②对于 粒子在原子附近时由于原子呈中性,与
粒子在原子附近时由于原子呈中性,与 粒子之间没有或很小的库仑力的作用,正电荷在原子内部均匀的分布,
粒子之间没有或很小的库仑力的作用,正电荷在原子内部均匀的分布, 粒子穿过原子时,由于原子两侧正电荷将对它的斥力有相当大一部分互相抵消,使
粒子穿过原子时,由于原子两侧正电荷将对它的斥力有相当大一部分互相抵消,使 粒子偏转的力不会很大所以
粒子偏转的力不会很大所以 粒子大角度散射说明葡萄干布丁模型不符合原子结构的实际情况。
粒子大角度散射说明葡萄干布丁模型不符合原子结构的实际情况。
对于问题3:讨论、推理、分析得到卢瑟福的原子结构模型。
小结:实验中发现极少数 粒子发生了大角度偏转,甚至反弹回来,表明这些
粒子发生了大角度偏转,甚至反弹回来,表明这些 粒子在原子中某个地方受到了质量、电量均比它本身大得多的物体的作用,可见原子中的正电荷、质量应都集中在一个中心上。
粒子在原子中某个地方受到了质量、电量均比它本身大得多的物体的作用,可见原子中的正电荷、质量应都集中在一个中心上。
①绝大多数 粒子不偏移→原子内部绝大部分是“空”的。
粒子不偏移→原子内部绝大部分是“空”的。
②少数 粒子发生较大偏转→原子内部有“核”存在。
粒子发生较大偏转→原子内部有“核”存在。
③极少数 粒子被弹回 表明:作用力很大;质量很大;电量集中。
粒子被弹回 表明:作用力很大;质量很大;电量集中。
点评:教师进行科学研究方法教育:模型法
(实验现象)→(分析推理)→(构造模型)
(通过汤姆生的原子结构模型到卢瑟福的原子的核式结构模型的建立,既渗透科学探究的因素教学,又进行了模型法的教学,并将卢瑟福的原子的核式结构模型与行星结构相类比,指出大自然的和谐统一的美,渗透哲学教育。通过学生对这三个问题的讨论与交流,顺理成章地否定了葡萄干布丁模型,并开始建立新的模型。希望这一部分由学生自己完成,教师总结,总结时,突出汤姆生原子模型与 粒子散射实验之间的矛盾,可以将
粒子散射实验之间的矛盾,可以将 粒子分别穿过葡萄干布丁模型和核式结构模型的不同现象用动画模拟,形成强烈的对比,突破难点)得到卢瑟福的原子的核式结构模型后再展示立体动画
粒子分别穿过葡萄干布丁模型和核式结构模型的不同现象用动画模拟,形成强烈的对比,突破难点)得到卢瑟福的原子的核式结构模型后再展示立体动画 粒子散射模型,使学生有更清晰的直观形象、生动的认识。
粒子散射模型,使学生有更清晰的直观形象、生动的认识。
1、 粒子散射实验原理、装置
粒子散射实验原理、装置
(1) 粒子散射实验原理:
粒子散射实验原理:
问题:汤姆生提出的葡萄干布丁原子模型是否对呢?
原子的结构非常紧密,用一般的方法是无法探测它的内部结构的,要认识原子的结构,需要用高速粒子对它进行轰击。而 粒子具有足够的能量,可以接近原子中心。它还可以使荧光屏物质发光。如果
粒子具有足够的能量,可以接近原子中心。它还可以使荧光屏物质发光。如果 粒子与其他粒子发生相互作用,改变了运动方向,荧光屏就能够显示出它的方向变化。研究高速的
粒子与其他粒子发生相互作用,改变了运动方向,荧光屏就能够显示出它的方向变化。研究高速的 粒子穿过原子的散射情况,是研究原子结构的有效手段。
粒子穿过原子的散射情况,是研究原子结构的有效手段。
指出:研究原子内部结构要用到的方法:黑箱法、微观粒子碰撞方法。
(2) 粒子散射实验装置
粒子散射实验装置
 粒子散射实验的装置,主要由放射源、金箔、荧光屏、望远镜和转动圆盘几部分组成。
粒子散射实验的装置,主要由放射源、金箔、荧光屏、望远镜和转动圆盘几部分组成。 粒子散射实验在课堂上无法直接演示,希望借助多媒体系统,利用动画向学生模拟实验的装置、过程和现象,使学生获得直观的切身体验,留下深刻的印象。通过多媒体重点指出,荧光屏和望远镜能够围绕金箔在一个圆周上运动,从而可以观察到穿透金箔后偏转角度不同的
粒子散射实验在课堂上无法直接演示,希望借助多媒体系统,利用动画向学生模拟实验的装置、过程和现象,使学生获得直观的切身体验,留下深刻的印象。通过多媒体重点指出,荧光屏和望远镜能够围绕金箔在一个圆周上运动,从而可以观察到穿透金箔后偏转角度不同的 粒子。并且要让学生了解,这种观察是非常艰苦细致的工作,所用的时间也是相当长的。动画展示
粒子。并且要让学生了解,这种观察是非常艰苦细致的工作,所用的时间也是相当长的。动画展示 粒子散射实验装置动画展示实验中,通过显微镜观察到的现象。
粒子散射实验装置动画展示实验中,通过显微镜观察到的现象。
(3)实验的观察结果
明确:入射的 粒子分为三部分。大部分沿原来的方向前进,少数发生了较大偏转,极少数发生大角度偏转。
粒子分为三部分。大部分沿原来的方向前进,少数发生了较大偏转,极少数发生大角度偏转。
汤姆生发现电子,根据原子呈电中性,提出了原子的葡萄干布丁模型。用动画展示原子葡萄干布丁模型。
9、下表为周期表的一部分,其中的字母代表对应的元素
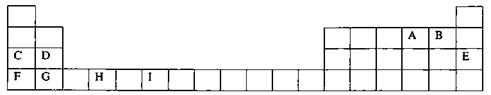
请回答下列问题:
 (1)写出元素I的基态原子的价电子排布式 ;已知M2+离子3d轨道中有6个电子,试推出M元素位于周期表的 周期
族。
(1)写出元素I的基态原子的价电子排布式 ;已知M2+离子3d轨道中有6个电子,试推出M元素位于周期表的 周期
族。
(2)请列举F的金属性比C强的实验事实: ,并用原子结构理论解释其原因:__________________________________________
(3)H、A、G三种元素形成的晶体是一种矿物的主要成分,其晶胞结构如左图,则该晶体的化学式为 ;在该晶体中,G离子的配位数为 ;若晶胞的边长为acm,则晶体的密度为 g/cm3
8、某物质的晶体中,含A、B、C三种元素,其排列方式如右图所示(其中前后两面心上的B原子不能画出),晶体中A、B、C的原子个数比依次为 ( )
 A.1:3:1
A.1:3:1
B.2:3:1
C.2:2:1
D.1:3:3
7、已知:元素X的电负性数值为2.5,元素Y的电负性数值是3.5,元素Z的电负性数值为1.2,元素W的电负性数值为2.4。你认为上述四种元素中,哪两种最容易形成离子化合物 ( )
A.X与Y B.X与W C.Y与Z D.Y与W
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com