
11.三种元素的微粒Xn-、Y8+、zn+都有相同的电子层结构,已知n>p,则它们核内质子数(依次用X′、Y′、Z′表示)的关系为 ( )
A.X′=Y′=Z′ B.Y′> Z′>X′
C.X′> Z′> Y′ D.Z′= Y′>X′
10.据权威刊物报道,1996年科学家在宇宙中发现H3分子。甲、乙、丙、丁四位学生对此报道的认识正确的是 ( )
A.甲认为上述发现绝对不可能,因为H3分子违背了共价键理论
B.乙认为宇宙中还可能存在另一种氢单质,因为氢元素有三种同位素必然有三种阿素异形体
C.丙认为H3屯分子实质上是H2分子与H+以特殊共价键结合的产物,应写成H3+
D.丁认为如上述发现存在,则证明传统的价键理论有一定的局限性有待继续发展
9.氨气分子空间构型是三角锥形,而甲烷是正四面体形,这是因为 ( )
A.两种分子中心原子杂化轨道类型不同,NH3为sp2型杂化,而CH4是sp3型杂化。
B.NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道。
C.NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强。
D.氨气分子是极性分子而甲烷是非极性分子。
8.某元素只存在两种天然同位素,且在自然界它们的含量相近,其相对原子质量为152,原子核外的电子数为63。下列叙述中错误的是 ( )
A.它是副族元素
B.它是第六周期元素
C.它的原子核内有63个质子
D.它的一种同位素的核内有89个中子
7.关于氢键,下列说法正确的是 ( )
A.每一个水分子内含有两个氢键
B.冰、液氨和溴苯中都存在氢键
C.分子间形成的氢键使物质的熔点和沸点升高
D.H2O是一种非常稳定的化合物,这是由于氢键所致
6.下列气态中性基态原子的第一电离能最大的是 ( )
A.1s22s22p63s23p2
B.1s22s22p63s23p3
C.ls22s22p63s23p4
D.1s22s22p63s23p64s24p2
5.在乙烯分子中有5个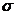 键、一个π键,它们分别是 ( )
键、一个π键,它们分别是 ( )
A.sp2杂化轨道形成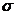 键、未杂化的2p轨道形成π键
键、未杂化的2p轨道形成π键
B.sp2杂化轨道形成π键、未杂化的2p轨道形成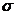 键
键
C.C-H之间是sp2形成的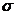 键,C-C之间是未杂化的2p轨道形成的π键
键,C-C之间是未杂化的2p轨道形成的π键
D.C-C之间是sp2形成的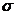 键,C-H之间是未杂化的2p轨道形成的π键
键,C-H之间是未杂化的2p轨道形成的π键
4.下列原子或离子原子核外电子排布不属于基态排布的是 ( )
A.N:ls22s22p3 B.S2-:ls22s22p63s23p6
C.Na:ls22s22p53s2 D.Si:ls22s22p63s23p2
3.最近,意大利科学家使用普通氧分子和带正电荷的氧离子制造出了由4个氧原子构成的氧分子,并用质谱仪探测到了它存在的证据。若该氧分子具有空间对称结构,下列关于该氧分子的说法正确的是 ( )
A.是一种新的氧化物 B.不可能含有极性键
C.是氧元素的一种同位素 D.是臭氧的同分异构体
2.下列分子或离子中,能提供孤对电子与某些金属离子形成配位键的是 ( )
①H2O ②NH3 ③Cl- ④SCN-
A.①② B.①②③ C.①②④ D.①②③④
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com