
11. 向A、B两种黑色粉末中分别加入盐酸并加热,观察到如下现象:
|
物质 |
观察到的现象 |
|
A |
溶解并放出气体,溶液变浅绿色。气体在空气中燃烧时,若将一块玻璃片放于火焰上,玻璃片上有浅黄色的物质生成 |
|
B |
溶解后无气体产生。加入足量氨水,产生白色沉淀,且沉淀迅速变成灰绿色,最后变为红褐色 |
(1)据此确定这两种粉末各是什么物质(写化学式):A________,B________。
(2)能说明物质B的后一现象的化学方程式是__________________________
10. 四种黑色粉末CuO、FeO、MnO2、C(石墨粉)只需加入一种试剂即可将它们区别开来, 这种试剂是
A.NaOH溶液 B.稀H2SO4 C.浓盐酸 D.蒸馏水
9. 在高温下用一氧化碳还原m克四氧化三铁得到n克铁。已知氧的原子量为16, 则铁的原子量为
A.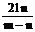 B.
B.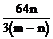 C.
C. D.
D.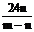
8. 下列各组的两种溶液中,分别加入足量氨水,观察到的现象相同的是 B
A.FeCl3 AlCl3 B.NaCl BaCl2 C.MgCl2 CuCl2 D.FeCl2 FeCl3
7. 某化学兴趣小组在空气中加热硫粉与铁粉的混合物制取FeS。现有浓H2SO4、浓HNO3
稀HCl 、稀HNO3、FeCl3溶液、NH4SCN溶液,请用最简便可靠的实验方法检验残余固体中是否含有少量的Fe2O3
6. (1)已知2Fe2++Br2=2Fe3++2Br–试写出在FeBr2溶液中通入少量氯气的离子方程式
(2)比较Fe3+与I–的还原性强弱,试举一个具体的反应式来说明
在FeI2溶液中通入少量氯气的离子方程式
(3)在标准状况下11.2 L氯气通入含0.5 mol FeBr2的溶液中发生反应的离子方程式是( )
( A )2Fe2++Cl2=2Fe3++2Cl– ( B )2Br–+Cl2=Br2+2Cl–
( C )2Fe2++2Br–+2Cl2=2Fe3++Br2+4Cl– ( D )2Fe2++4Br–+3Cl2=2Fe3++2Br2+6Cl–
5. 制印刷电路时常用氯化铁溶液作为“腐蚀液”,发生的反应为2FeCl3+Cu=2FeCl2+CuCl2。向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是
A. 烧杯中有铜无铁 B. 烧杯中有铁无铜
C. 烧杯中铁、铜都有 D. 烧杯中铁、铜都无
4. 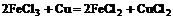 , 判断:
, 判断:  氧化性强弱的顺序是
氧化性强弱的顺序是
A. B.
B.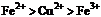
C.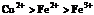 D.
D.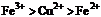
3. 下列离子方程式中正确的是
A.三氯化铁溶液中加入铁粉 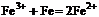
B.氯化镁溶液中加入硝酸银溶液 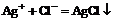
C. 过量氯气通入溴化亚铁溶液中 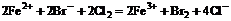
D.氢氧化铜溶于稀硫酸中 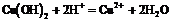
2. 某溶液中有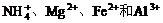 四种离子, 若向其中加入过量的氢氧化钠溶液, 微热并搅拌, 再加入过量盐酸; 溶液中大量减少的阳离子是
四种离子, 若向其中加入过量的氢氧化钠溶液, 微热并搅拌, 再加入过量盐酸; 溶液中大量减少的阳离子是
A.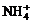 B.Mg2+ C.Fe2+ D.Al3+
B.Mg2+ C.Fe2+ D.Al3+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com