
15.(10分)(2010年安庆质检)某课外活动小组准备用如图所示的装置进行实验。现有甲、乙、丙三位同学分别选择了如下电极材料和电解质溶液:


(1)甲同学在实验中将电键K5闭合,Zn电极上的电极反应式为________________________________________________________________________。
(2)乙同学准备进行电解CuCl2溶液的实验,则电解时的总反应方程式为________________________________________________________________________;
实验时应闭合的电键组合是 。(从下列五项中选择所有可能组合,第三小题也在这五项中选择)
A.K1和K2 B.K1和K3
C.K1和K4 D.K2和K3
E.K2和K4
(3)丙同学准备在Fe上镀Cu,选择了某种盐来配制电镀液,则该盐的化学式为____________,实验时,应闭合的电键组合是________(选项如上)。
[解析] (1)闭合K5后构成原电池,Zn为负极。
(2)将电源与题给装置构成闭合回路即可。
(3)电镀时,选择含镀层金属离子的溶液为电镀液,Fe应连接电源的负极,Cu连接电源的正极。
[答案] (1)Zn―→Zn2++2e-
(2)CuCl2Cu+Cl2↑ C、D
(3)CuCl2或CuSO4 D
14.(9分)如图装置,A、B中电极为多孔的惰性电极;C、D为夹在湿的Na2SO4滤纸条上的铂夹;电源有a、b两极。若在A、B中充满KOH溶液后倒立于KOH溶液的水槽中,切断K1,闭合K2、K3,通直流电,则:

(1)标出电源的正、负极,a为 极。
(2)在湿的Na2SO4滤纸条中心的KMnO4液滴,有什么现象 。
(3)写出电极反应式:A中________________________________________________________________________。
(4)若电解一段时间,A、B中均有气体包围电极。此时切断K2、K3,闭合K1。电流表的指针偏转,则此时A极电极反应式为 。
[解析] 切断K1,闭合K2、K3时,在A、B、C、D电极上均发生电解反应。由图可知,B中产生的气体体积较大,故B应为阴极,故a为负极。滤纸上溶液中的电流方向应为D―→C。故紫色的MnO4-在电场的作用下会向阳极(D处)移动。
切断K2、K3,闭合K1后,会发生原电池反应。B中H2做负极,A中O2做正极。
[答案] (1)负 (2)紫色液滴向D处移动
(3)4OH-―→2H2O+O2↑+4e-
(4)O2+2H2O+4e-―→4OH-
13.(9分)(2010年瑞安质检)按要求写热化学方程式:
(1)已知稀溶液中,1 mol H2SO4与NaOH溶液恰好完全反应时,放出114.6 kJ热量,写出表示H2SO4与NaOH反应的中和热的热化学方程式________________________________________________________________________
__________________________。
(2) 25 ℃、101 kPa条件下充分燃烧一定量的丁烷气体放出热量为Q kJ,经测定,将生成的CO2通入足量澄清石灰水中产生25 g白色沉淀,写出表示丁烷燃烧热的热化学方程式
________________________________________________________________________。
(3)如图是101 kPa时氢气在氯气中点燃生成氯化氢气体的能量变化示意图:

写出此反应的热化学方程式________________________________________________。
(4)已知下列热化学方程式:
①CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l)
ΔH1=-870.3 kJ/mol
②C(s)+O2(g)===CO2(g) ΔH2=-393.5 kJ/mol
③H2(g)+O2(g)===H2O(l) ΔH3=-285.8 kJ/mol
写出由C(s)、H2(g)和O2(g)化合生成CH3COOH(l)的热化学方程式____________________________________________。
[解析] (1)由中和热的定义可知,1 mol NaOH与 mol H2SO4生成1 mol水时放热57.3 kJ。
(2)CO2通入澄清石灰水中产生25 g白色沉淀,即n(CO2)=0.25 mol,则n(C4H10)= mol,1 mol 丁烷完全燃烧放出热量16Q kJ。
(3)1 mol H2与1 mol Cl2反应生成2 mol HCl的热效应是:
ΔH=436 kJ/mol+243 kJ/mol-2×431 kJ/mol=-183 kJ/mol。
(4)合成CH3COOH的反应为:
2C(s)+2H2(g)+O2(g)===CH3COOH(1)
根据盖斯定律,②×2+③×2-①即得,ΔH=(-393.5 kJ/mol)×2+(-285.8 kJ/mol)×2-(-870.3 kJ/mol)=-488.3 kJ/mol。
[答案] (1)H2SO4(aq)+NaOH(aq)===Na2SO4(aq)+H2O(1) ΔH=-57.3 kJ/mol
(2)C4H10(g)+O2(g)===4CO2(g)+5H2O(l)
ΔH=-16Q kJ/mol
(3)H2(g)+Cl2(g)===2HCl(g) ΔH=-183 kJ/mol
(4)2C(s)+2H2(g)+O2(g)===CH3COOH(l)
ΔH=-488.3 kJ/mol
12.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:
3Zn+2K2FeO4+8H2O放电充电3Zn(OH)2+2Fe(OH)3+4KOH
下列叙述不正确的是( )
A.放电时负极反应为:3Zn+6OH-―→3Zn(OH)2+6e-
B.充电时阳极反应为:2Fe(OH)3+10OH-―→2FeO42-+8H2O+6e-
C.放电时每转移3 mol电子,正极有1 mol K2FeO4被氧化
D.放电时正极附近溶液的碱性增强
[解析] 放电时:负极为3Zn+6OH-―→3Zn(OH)2+6e-,正极为2FeO42-+6e-+8H2O―→2Fe(OH)3+10OH-,所以A、D正确,放电时每转移3 mol电子,正极有1 mol FeO42-即K2FeO4被还原;充电时:阴极:3Zn(OH)2+6e-―→3Zn+6OH-,阳极:2Fe(OH)3+10OH-―→2FeO42-+8H2O+6e-,B正确。
[答案] C
11.(2010年金华质检)有关下图装置的叙述不正确的是( )


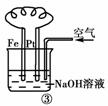

A.图①铝片发生的电极反应式是:Al+4OH-―→[Al(OH)4]-+3e-
B.图②b电极的电极反应式为:4OH-―→2H2O+O2↑+4e-
C.图③溶液中发生了变化:4Fe(OH)2+O2+2H2O===4Fe(OH)3
D.图④充电时,阳极反应是:PbSO4+2H2O―→PbO2+SO42-+4H++2e-
[解析] 图①中铝能与NaOH溶液自发反应,所以铝为负极,A项正确;图②为氢氧燃料电池,b电极为正极,氧气得到电子,B项错误;图③为铁的吸氧腐蚀,铁失去电子生成的Fe2+与溶液中的OH-结合形成Fe(OH)2,其不稳定继续被空气中的氧气氧化,C项正确;图④充电时,阳极与外接电源的正极相连,使PbSO4失去电子重新生成PbO2,D项正确。
[答案] B
10.已知下列热化学反应方程式:
Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g)
ΔH=-24.8 kJ/mol
Fe2O3(s)+CO(g)===Fe3O4(s)+CO2(g)
ΔH=-15.73 kJ/mol
Fe3O4(s)+CO(g)===3FeO(s)+CO2(g)
ΔH=+640.4 kJ/mol
则14 g CO气体还原足量FeO固体得到Fe固体和CO2气体时对应的ΔH约为( )
A.-218 kJ/mol B.-109 kJ/mol
C.+218 kJ/mol D.+109 kJ/mol
[解析] 该问题可以转化为CO(g)+FeO(s)===Fe(s)+CO2(g) ΔH=?所以应用盖斯定律,若把已知给出的3个热化学方程式按照顺序编号为①、②、③,那么[(①-②)×-③]×即可。
[答案] B
9.通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可用于估算化学反应的反应热(ΔH),化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
|
化学键 |
H-H |
Cl-Cl |
H-Cl |
|
生成1 mol 化学键时 放出的能量 |
436 kJ·mol-1 |
243 kJ·mol-1 |
431 kJ·mol-1 |
则下列热化学方程式不正确的是( )
A.H2(g)+Cl2(g)===HCl(g) ΔH=-91.5 kJ·mol-1
B.H2(g)+Cl2(g)===2HCl(g) ΔH=-183 kJ·mol-1
C.H2(g)+Cl2(g)===HCl(g) ΔH=+91.5 kJ·mol-1
D.2HCl(g)===H2(g)+Cl2(g) ΔH=+183 kJ·mol-1
[解析] 本题考查反应热与键能的关系:ΔH=反应物键能总和-生成物键能总和。C项的反应是放热反应,C错误;ΔH=×436 kJ·mol-1-431 kJ·mol-1+×243 kJ·mol-1=-91.5 kJ·mol-1。
[答案] C
8.下列各组热化学方程式中,化学反应的ΔH前者大于后者的是( )
①C(s)+O2(g)===CO2(g) ΔH1 C(s)+O2(g)===CO(g) ΔH2
②S(s)+O2(g)===SO2(g) ΔH3 S(g)+O2(g)===SO2(g) ΔH4
③H2(g)+O2(g)===H2O(g) ΔH5 2H2(g)+O2(g)===2H2O(g) ΔH6
④CaCO3(s)===CaO(s)+CO2(g) ΔH7 CaO(s)+H2O(l)===Ca(OH)2(s) ΔH8
A.① B.④
C.②③④ D.①②③
[解析] ①中C(s)完全燃烧反应放出的热量更多,ΔH1<ΔH2。②中S(g)燃烧放热更多,ΔH3>ΔH4。③中ΔH6=2ΔH5,反应放热,故ΔH5>ΔH6。④中ΔH7>0,ΔH8<0。
[答案] C
7.关于金属腐蚀的下列叙述中,不正确的是( )
A.铁器生锈、铜器长出“铜绿”、银制器皿表面变暗,都属于金属腐蚀
B.生铁比软铁芯(几乎是纯铁)容易生锈
C.铆在铜板上的铁钉在潮湿空气中容易生锈
D.家用炒菜铁锅用水清洗放置后出现的锈斑主要成分是Fe3O4
[解析] D项不正确,铁锈的主要成分是Fe2O3。
[答案] D
6.下列能说明锌比铜活泼的装置是( )
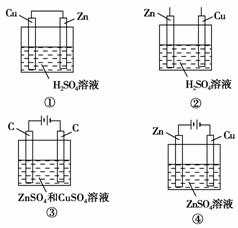
A.①③④ B.②③④
C.①②④ D.①②③
[解析] ①是原电池装置,Zn作负极,则金属活泼性Zn>Cu;②中Zn、Cu分别插入H2SO4溶液中,Zn与H2SO4反应而Cu不能反应,说明Zn比Cu活泼;③用惰性电极电解ZnSO4和CuSO4的混合溶液,Cu2+首先在阴极上放电,说明氧化性:Cu2+>Zn2+,则金属活泼性:Zn>Cu;④是电镀池,铜作阴极被保护,不能说明锌比铜活泼。
[答案] D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com