
10、若关于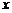 不等式
不等式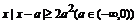 的解集为
;
的解集为
;
9、在如图所示的坐标平面的可行域内(阴影部分且包括边界),
目标函数 取得最优解有无数个,则
取得最优解有无数个,则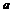 的一个可能值为
的一个可能值为
A、-3 B、3 D、-1 D、1
8、 设点
设点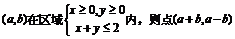 所在的区域的面积为
所在的区域的面积为
A、1 B、2 C、4 D、8
7、设奇函数 在[-1,1]上是增函数,且
在[-1,1]上是增函数,且 ,若函数
,若函数 对所有的
对所有的 都成立,当
都成立,当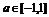 时t的取值范围为
时t的取值范围为
A、[-2,2] B、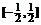 C、
C、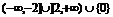 D、
D、
6、已知函数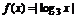 ,若
,若 ,则
,则 的取值范围为
的取值范围为
A、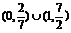 B、
B、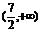 C、
C、 D、
D、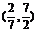
5、函数 在(-1,1)上有定义且
在(-1,1)上有定义且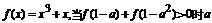 的取值范围为
的取值范围为
A、(-2,1) B、(0,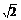 )
C、(0,1)
D、(-2,
)
C、(0,1)
D、(-2,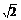 )
)
3、已知奇函数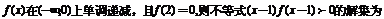

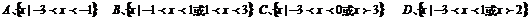 4、
4、 是定义在(0,3)上的函数,
是定义在(0,3)上的函数, 的图象如图所示,则不等式
的图象如图所示,则不等式 的解集 是
的解集 是
A.(0,1) (2,3)B.
(2,3)B.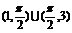
C.(0,1)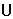
 D.(0,1)
D.(0,1) (1,3)
(1,3)
2、已知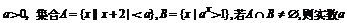 的取值范围为
的取值范围为
A、 B(0,1) C、(0,1)
B(0,1) C、(0,1)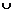
 D、(0,1)
D、(0,1)
17.(12分)甲醛是一种重要的化工产品,可利用甲醇催化脱氢制备。甲醛与气态甲醇转化的能量关系如下图所示。
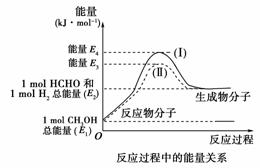
(1)甲醇催化脱氢转化为甲醛的反应是 (填“吸热”或“放热”)反应。
(2)过程Ⅰ与过程Ⅱ的反应热是否相同? 原因是________________________________________________________________________
________________________________________________________________________
。
(3)写出甲醇催化脱氢转化为甲醛的热化学反应方程式
________________________________________________________________________。
(4)甲醇催化脱氢转化为甲醛的过程中,如果要使反应温度维持在700 ℃,需向体系中通入空气,则进料甲醇与空气的物质的量理论比值为________[假设:H2(g)+O2(g)===H2O(g) ΔH=-a kJ·mol-1,空气中氧气体积分数为0.2]。
[答案] (1)吸热 (2)相同 一个化学反应的反应热仅与反应的起始状态和反应的最终状态有关,而与反应的途径无关
(3)CH3OH(g)HCHO(g)+H2(g)
ΔH=(E2-E1)kJ·mol-1
(4)
16.(10分)(2010年潍坊质检)如图甲、乙是电化学实验装置。

(1)若甲、乙两烧杯中均盛有NaCl溶液。
①甲中石墨棒上的电极反应式为______________________;
②乙中总反应的离子方程式为______________________;
③将湿润的淀粉KI试纸放在乙烧杯上方,发现试纸先变蓝后褪色,这是因为过量的Cl2氧化了生成的I2。若反应中Cl2和I2的物质的量之比为5∶1,且生成两种酸,该反应的化学方程式为__________________。
(2)若甲、乙两烧杯中均盛有CuSO4溶液。
①甲中铁棒上的电极反应式为________________;
②如果起始时乙中盛有200 mL pH=5的CuSO4溶液(25 ℃),一段时间后溶液的pH变为1,若要使溶液恢复到电解前的状态,可向溶液中加入____________________(填写物质的化学式)________g。
[解析] (1)若两烧杯中均盛有NaCl溶液,则:①甲装置为原电池,石墨棒作正极,O2放电,电极反应为:O2+2H2O+4e-―→4OH-。②乙装置为电解池,石墨棒上发生氧化反应,Fe电极不参与反应,其实质与用惰性电极电解食盐水相同,离子方程式为2Cl-+2H2OCl2↑+H2↑+2OH-。③Cl2和I2的物质的量之比为5∶1,生成HCl和HIO3。(2)若两烧杯中均盛有CuSO4溶液,则:①甲装置为原电池,铁作负极,电极反应为:Fe―→Fe2++2e-。②乙装置为电解池,电解反应为:2CuSO4+2H2O2Cu+2H2SO4+O2↑,根据电解方程式,从电解质溶液中析出Cu,放出O2,因此只需加入CuO(或CuCO3)即可恢复到电解前的状态。由电解反应式可知,2H+-CuO-CuCO3,电解后n(H+)=0.1×0.2=0.02(mol),故m(CuO)=0.02××80=0.8(g),m(CuCO3)=0.02××124=1.24(g)。
[答案] (1)①O2+2H2O+4e-―→4OH-
②2Cl-+2H2O2OH-+H2↑+Cl2↑
③5Cl2+I2+6H2O===10HCl+2HIO3
(2)①Fe―→Fe2++2e- ②CuO(或CuCO3) 0.8(或1.24)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com