
2、根据课文内容说说下面的人创造性思维的特点。
⑴亚历山大。 ⑵第一个看到无用的锯末 想到可以用它压制成引火燃料的人。
想到可以用它压制成引火燃料的人。
⑶在飞机场上看时装的人。 ⑷建筑师。
讨论并归纳:
⑴亚历山大的思维有着积极的求异性,对常见的、惯用的做法持分析的态度。他的求异性表现在从不同角度、不同途径去设想,探求多种答案,最终使问题获得圆满的解决。亚历山大使人们从习惯性观察问题的角度发生了根本性转变。他的思维具有变通、独特的特性。其实这则有关亚历山大的寓言也折 射出与哥伦布竖鸡蛋一样简单而浅显的道理。
射出与哥伦布竖鸡蛋一样简单而浅显的道理。
⑵将无用的锯末变为有用的引火燃料,表现出敏锐的洞察力,发明者将观察到的事物和已有知识或 假说联系思考,把锯末与引燃材料之间的相似性、特异性、重复性加以比较,发现其必然联系、本质现象。只有独具慧眼、观察敏锐,洞识其潜
假说联系思考,把锯末与引燃材料之间的相似性、特异性、重复性加以比较,发现其必然联系、本质现象。只有独具慧眼、观察敏锐,洞识其潜 在意义,才能抓住时机,作出创造。
在意义,才能抓住时机,作出创造。
⑶飞机场上人来人往,不同肤色,不同民族,不同文化背景的人穿着不同服饰的人,汇集在一起,可以说是一个万国时装展。做为时装设计师在这里他才会有活跃的灵感,这时人脑以最优越的功能,加工处理各种各样的信息。因注意力高度集中,想象骤然活跃,思维特别敏锐,情绪异常激昂。
⑷在绿地间铺设人行道的做法是逆向思维,它突破了思维定势,从对立的,颠倒的,相反的角度去思考问题。通常是先铺道再走人,现在是先走人,根据人常走的轨迹及路的宽窄来铺设人行道,既 优雅自然,又
优雅自然,又 满足了行人的需要。设计者在思维过程中把注意力转到外部因素,从而找到问题限定条件下的常规方法之外的新思路,也就是在特定的条件下,将思维流向从侧面去扩展和推广或利用“
满足了行人的需要。设计者在思维过程中把注意力转到外部因素,从而找到问题限定条件下的常规方法之外的新思路,也就是在特定的条件下,将思维流向从侧面去扩展和推广或利用“ 局外”信息,来发现解决问题的途径。
局外”信息,来发现解决问题的途径。
 从以上例子可以看出创造性思维如下的特点:积极的求异性,敏锐的洞察力,创造性的想象,活跃的灵感。
从以上例子可以看出创造性思维如下的特点:积极的求异性,敏锐的洞察力,创造性的想象,活跃的灵感。
这篇课文是思想录,作者想到了一点写一点,记录了思想的火花,有的来自小故事,有的来自名人名言,有的来自生活感触。
1、读了全文之后请你试着说说创造性思维的含义及特征。
讨论并归纳:
提示:创造性思维就是在思维领域追求“独到”和“最佳”,在前人、常人的基础上有新的见解、新的发现、新的突破的思维。也可以说,创造性思维是指有创见的思维,即通过思维不仅能揭示事物的本质,且能在此基础上提供新的、具有社会价值的产物。
当今社会,科学技术突飞猛进,知识更新速度和高新技术产业化日益加快,知识经济--一种全新的基于最新科技和人类知识精华的经济形态--已初见端倪。在这经济转变的时代,国家的创新能力,包括知识创新能力和技术创新能力,是决定一个国家在国际竞争和全球多极化格局中地位的重要因素。江泽民同志说:“创新是一个民族进步的灵魂,是国家兴旺发达的不竭动力。 一个国家如果自主创新能力上不去,一味靠技术引进,就永远难以摆脱技术落后的局面。”今天我们来学习《创造学思想录》,你一定会得到很多的启示。
一个国家如果自主创新能力上不去,一味靠技术引进,就永远难以摆脱技术落后的局面。”今天我们来学习《创造学思想录》,你一定会得到很多的启示。
例1判断下列叙述正确的是
A.标准状况下,1mol任何物质的体积都约为22.4L
B.1mol任何气体所含分子数都相同,体积也都约为22.4L
C.在常温常压下金属从盐酸中置换出1molH2转移电子数为1.204×1024
D.在同温同压下,相同体积的任何气体单质所含原子数目相同
选题角度:这是一道基础知识概念的理解题,涉及气体摩尔体积、化学反应及物质结构的初步知识。适合中等学生。
思路分析:根据标准状况下气体摩尔体积的定义,应注意:一是标准状况,二是指气体的体积而非固体或液体的体积,所以A、B两项均错;C项正确,物质的微粒数不受外界条件影响而变化;D项错,气体单质分子,可以是单原子分子如He,也可以是双原子分子如H2,还可以是多原子分子如O3,因此相同温度压强下相同体积的任何气体虽然分子数相同,但所含原子数不一定相同。
解答:C.
启示:抓住基础知识和基本概念,不仅可以轻松地进行解题,而且对概念的理解更加准确和深刻。
例2在一密闭气缸中,用一不漏气可滑动的活塞隔开,左边充有N2,右边充有H2和O2的混合气体,在20℃时,将右边混合气体点燃,反应后冷却到原来温度,若活塞原来离气缸左端的距离为总长的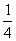 ,反应后静止于气缸的正中(忽略水蒸气),则原来H2和O2的体积比为(
)
,反应后静止于气缸的正中(忽略水蒸气),则原来H2和O2的体积比为(
)
(A)4:5 (B)5:4 (C)7:2 (D)2:1
解析:反应前:活塞两边气体均处于20℃,压强也相同,根据阿伏加德罗定律,右边混合气体的物质的量是N2的3倍。
反应后:活塞两边气体仍处于20℃,压强也相同,根据阿伏加德罗定律,右边剩余气体的物质的量与N2相等。
由于反应前后N2的体积虽然发生变化,但其物质的量没有改变,所以我们若假定N2为1mol时,H2和O2共3mol,反应后剩余气体即为1mol,那么混合气体从3mol变为1mol是什么原因造成的呢?是由以下反应引起的:2H2+O2 2H2O(液),这是一个气体物质的量减少的反应。现假定参加反应的氢气和氧气分别为xmol和ymol,根据差量法可以确定x和y:
2H2O(液),这是一个气体物质的量减少的反应。现假定参加反应的氢气和氧气分别为xmol和ymol,根据差量法可以确定x和y:
2H2+O2=2H2O 气体物质的量的减少
2 1 3
x y 3-1=2mol
显然:x=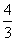 ,y=
,y=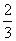 。x+y=2≠3,说明有气体剩余,那么剩余的1mol气体是什么呢?应该是氢气或氧气都有可能。讨论如下:
。x+y=2≠3,说明有气体剩余,那么剩余的1mol气体是什么呢?应该是氢气或氧气都有可能。讨论如下:
①若氢气有剩余,则氧气的物质的量为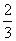 mol,氢气的物质的量为:
mol,氢气的物质的量为: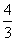 +1=
+1= mol,即体积比等于物质的量之比为7:2。
mol,即体积比等于物质的量之比为7:2。
②若氧气有剩余,则氢气的物质的量为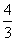 mol,氧气的物质的量为:
mol,氧气的物质的量为: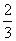 +1=
+1= mol,即体积比等于物质的量之比为4:5。
mol,即体积比等于物质的量之比为4:5。
所以本题应选A、C。
例3如果ag某气体中含有的分子数为b,则cg该气体在标准状况下的体积是
A.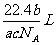 B.
B. C.
C.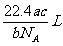 D.
D.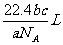
选题角度: 深刻理解物质的量、摩尔质量、质量、气体摩尔体积和粒子数之间的关系,培养分析、思维的能力。
思路分析:该气体的分子数为b,则物质的量为 mol,
mol,
摩尔质量M=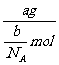 =
=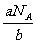 g/mol,
g/mol,
cg气体的物质的量为 n=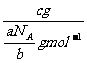 =
=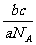 mol.
mol.
cg该气体标况下体积V=n•22.4L/mol=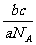 mol×22.4L/mol=
mol×22.4L/mol= L
L
解答:D
启示:深刻理解概念,掌握解题思路。
例4按体积比为4:2:3所组成的N2、O2、CO2,混合气体100g在标准状况下体积为___ L。
选题角度:a.学会求混合气体平均相对分子质量。b.加深对气体摩尔体积和阿伏加德罗定律的理解。
思路分析:先根据阿伏加德罗定律求出混合气体的平均相对分子质量,然后求出混合气体的物质的量,最后求出在标准状况下的体积。
根据阿伏加德罗定律,三种气体的体积比为4:2:3,物质的量之比也为4:2:3,可当作4mol,2mol,3mol.
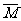 =
=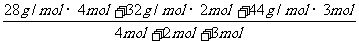
=34.2g/mol
混合气体总物质的量为 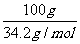 =2.92mol
=2.92mol
体积应为 2.92 mol ×22.4 L/mol = 65.4 L
解答:65.4L
启示:阿伏加德罗定律的推论之一:同温同压下,任何气体的体积比等于它们的物质的量之比,即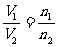
例5体积为1L干燥容器中充入HCl气体后,测得容器中气体对氧气的相对密度为1.082。将此气体倒扣在水中,进入容器中液体的体积是( )
(A)0.25L (B)0.5L (C)0.75L (D)1L
选题角度:此题主要考查气体平均摩尔质量的求法。
解析: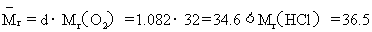 ,故该混合气体中必混有空气。HCl易溶于水,空气不溶于水,故进入容器中液体的体积等于HCl气体的体积。设HCl气体的体积为x,则空气的体积为(1L-x)。
,故该混合气体中必混有空气。HCl易溶于水,空气不溶于水,故进入容器中液体的体积等于HCl气体的体积。设HCl气体的体积为x,则空气的体积为(1L-x)。
根据气体平均摩尔质量计算公式: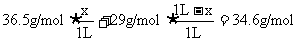 ,解得x=0.75L。
,解得x=0.75L。
答案:C
点评:本题运用到了空气的平均相对分子质量(29),判断空气的存在应用到了平均值法规律。
例6相同质量的钠、镁、铝分别跟足量稀硫酸反应,在同温、同压下产生气体的体积比为__________;如果这三种金属各取等物质的量,也分别跟足量稀硫酸反应,在同温同压下产生气体的体积比为_________________。
选题角度:此题有一定的代表性,可以通过此题找到一定的解题规律。
解析:不同金属与稀硫酸反应产生氢气的物质的量的多少,是由金属的物质的量与其化合价之乘积决定的。若各取1gNa、Mg、Al,三者物质的量与其化合价的乘积之比为: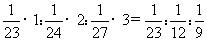 ,同温同压下产生氢气的体积比是由产生氢气的物质的量之比决定的,所以相同质量的Na、Mg、Al分别跟足量稀硫酸反应,在同温同压下产生气体的体积之比为
,同温同压下产生氢气的体积比是由产生氢气的物质的量之比决定的,所以相同质量的Na、Mg、Al分别跟足量稀硫酸反应,在同温同压下产生气体的体积之比为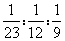 。当物质的量之比Na:Mg:Al=1:1:1时,分别跟足量稀硫酸反应产生氢气的物质的量之比为(1×1):(1×2):(1×3)=1:2:3,所以等物质的量的Na、Mg、Al与稀硫酸反应产生氢气的体积之比为1:2:3。
。当物质的量之比Na:Mg:Al=1:1:1时,分别跟足量稀硫酸反应产生氢气的物质的量之比为(1×1):(1×2):(1×3)=1:2:3,所以等物质的量的Na、Mg、Al与稀硫酸反应产生氢气的体积之比为1:2:3。
答案: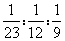 ;1:2:3。
;1:2:3。
点评:通过此题可以推广:若Na、Mg、Al分别和足量的稀硫酸作用,产生相同状况下相同体积的氢气,则三种金属的物质的量之比是6:3:2,三种金属的质量比是23:12:9。教师可以让学生利用多种解法得出答案,然后总结结论,以后解题可以提高准确率和速度。
例7将一小块焦炭和mg氧气,同时放入一装有压力表的密闭容器中,压强为p0,容器内充分反应后,恢复至原温,压力表示为p1
(1)若p0< p1,则焦炭质量W应满足的关系式是什么?
(2)若p0= p1,则W应满足的关系式是什么?
(3)若p1是p0的n倍,则W是多少?
选题角度:本题考查气体体积、压强与物质的量之间的关系。
解析:有关反应为C+O2=CO2 ①
CO2+C=2CO ②
或2C+O2=2CO ③
当C不足:只按①式,在气体体积不变,p1=p0。
当C过量:只按③式,在气体体积为原来2倍,p1=2p0。
当生成CO与CO2混合气体时,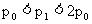 。
。
则(1)若p0< p1时: 则:W>
则:W>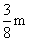
(2)若p0=
p1时: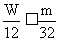 则:W≤
则:W≤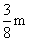
(3)若p1是p0的n倍:1≤n≤2
则n=1时:W≤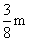
n=2时: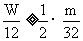 即:W≥
即:W≥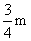
则: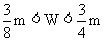
答案:(1)W>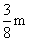 ;(2)W≤
;(2)W≤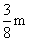 ;(3)
;(3)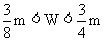
点评:此题具有一定的难度和综合性,解题时要注意考虑完全。例如:本题中反应时可以只是生成CO;只是生成CO2;生成CO和与CO2的混合气体三种情况。
定义 1摩理想气体在标准状况下的P0V0/T0值,叫做摩尔体积常数,简称气体常数。符号 R
R=(8.314510 0.000070)J/(mol••••K)。它的计算式是
0.000070)J/(mol••••K)。它的计算式是
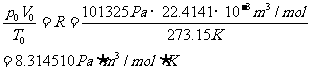
原理 用已知质量的镁条跟过量的酸反应产生氢气。把这氢气的体积、实验时的温度和压强代入理想气体状态方程(PV=nRT)中,就能算出摩尔气体常数R的值。氢气中混有水蒸气,根据分压定律可求得氢气的分压(p(H2)=p(总)-p(H2O)),不同温度下的p(H2O)值可以查表得到。
操作 (1)精确测量镁条的质量
方法一:用分析天平称取一段质量约10mg的表面被打亮的镁条(精确到1mg)。
方法二:取10cm长的镁带,称出质量(精确到0.1g)。剪成长10mm的小段(一般10mm质量不超过10mg),再根据所称镁带质量求得每10mm镁条的质量。
把精确测得质量的镁条用细线系住。
(2)取一只10 mL小量筒,配一单孔塞,孔内插入很短一小段细玻管。在量筒里加入2~3mL6mol/L硫酸,然后十分仔细地向筒内缓慢加入纯水,沾在量筒壁上的酸液洗下,使下层为酸,上层为水,尽量不混合,保证加满水时上面20~30mm的水是中性的。
(3)把系有细线的镁条浸如量筒上层的水里,塞上带有玻璃管的橡皮塞,使塞子压住细绳,不让镁条下沉,量筒口的水经导管口外溢。这时量筒中和玻璃导管内不应留有气泡空隙。
(4)用手指按住溢满水的玻璃导管口,倒转量筒,使玻璃导管口浸没在烧杯里的水中,放开手指。这时酸液因密度大而下降,接触到镁带而发生反应,生成的氢气全部倒扣在量筒内,量筒内的液体通过玻璃导管慢慢被挤到烧杯中。
(5)镁条反应完后再静置3~5分钟,使量筒内的温度冷却到室温,扶直量筒,使量筒内水面跟烧杯的液面相平(使内、外压强相同),读出量筒内气体的体积数。由于气体的体积是倒置在量筒之中,实际体积要比读数体积小约0.2mL,所以量筒内实际的氢气体积VH2=体积读数-0.20mL(用10mL的量筒量取)
(6)记录实验时室内温度(t℃)和气压表的读数(p大气)。
计算 (1)根据化学方程式和镁条的质量算出生成氢气的物质的量(nH2)
(2) 按下列步骤计算氢气在标准状况下的体积。
查表得到室温下水的饱和蒸气压(pH20),用下式计算氢气的分压(pH2)
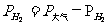
根据下式 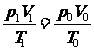
把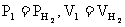 , T1=273+t, p0=100Kpa, T0=273K代入上式,得到标准状况下氢气的体积是
, T1=273+t, p0=100Kpa, T0=273K代入上式,得到标准状况下氢气的体积是
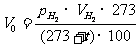

因此,摩尔体积常数(R)是
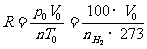
(1)由标准状况下气体密度求相对分子质量: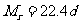
(2)由相对密度求气体的相对分子质量:若为对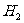 的相对密度则为:
的相对密度则为: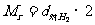 ,若为对空气的相对密度则为:
,若为对空气的相对密度则为: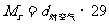 .
.
*(3)求混合气体的平均相对分子质量(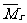 ):即混合气体1mol时的质量数值。在已知各组成气体的体积分数时见①,若为质量分数见②:
):即混合气体1mol时的质量数值。在已知各组成气体的体积分数时见①,若为质量分数见②:
①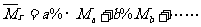
②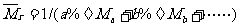
(4)由同温同压下气体反应时的体积比求分子数比,进而推分子式。
(5)直接将气体摩尔体积代入有关化学方程式进行计算。
(6)气体反应物的体积比即分子数比可便于找出过量气体。
(1)同温同压下,气体的体积比等于物质的量比。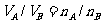
(2)同温同容下,气体的压强比等于物质的量比。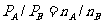
(3)同温同压下,气体的摩尔质量比等于密度比。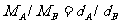
(4)同温同压下,同体积的气体质量比等于摩尔质量比。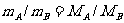
(5)同温同压下,同质量气体的体积比等于摩尔质量的反比。
此外还在运用时要结合物理中的同物质的量的气体在同温时,其体积与压强成反比;气体体积与热力学温度在同压条件下成正比。
12.(2008·海南、宁夏文,19)为了了解《中华人民共和国道路交通安全法》在学生中的普及情况,调查部门对某校6名学生进行问卷调查,6人得分情况如下:
5,6,7,8,9,10.
把这6名学生的得分看成一个总体.
(1)求该总体的平均数;
(2)用简单随机抽样方法从这6名学生中抽取2名,他们的得分组成一个样本.求该样本平均数与总体平均数之差的绝对值不超过0.5的概率.
解 (1)总体平均数为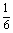 (5+6+7+8+9+10)=7.5.
(5+6+7+8+9+10)=7.5.
(2)设A表示事件“样本平均数与总体平均数之差的绝对值不超过0.5”.
从总体中抽取2个个体全部可能的基本结果有:
(5,6),(5,7),(5,8),(5,9),(5,10),(6,7),(6,8),(6,9),(6,10),(7,8),(7,9),(7,10),(8,9),(8,10),(9,10),共15个基本结果.
事件A包括的基本结果有:(5,9),(5,10),(6,8),(6,9),(6,10),(7,8),(7,9),共有7个基本结果.
所以所求的概率为P(A)=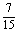 .
.
11.袋中装有黑球和白球共7个,从中任取两个球都是白球的概率为 .现有甲、乙两人从袋中轮流摸球,甲先取,乙后取,然后甲再取……取后不放回,直到两人中有1人取到白球时即终止.每个球在每一次被取出的机会是等可能的.
.现有甲、乙两人从袋中轮流摸球,甲先取,乙后取,然后甲再取……取后不放回,直到两人中有1人取到白球时即终止.每个球在每一次被取出的机会是等可能的.
(1)求袋中原有白球的个数;
(2)求取球2次终止的概率;
(3)求甲取到白球的概率.
解 (1)设袋中有n个白球,从袋中任取2个球是白球的结果数是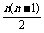 .
.
从袋中任取2个球的所有可能的结果数为 =21.
=21.
由题意知 =
=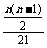 =
=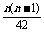 ,
,
∴n(n-1)=6,解得n=3(舍去n=-2).
故袋中原有3个白球.
(2)记“取球2次终止”为事件A,则P(A)=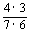 =
=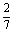 .
.
(3)记“甲取到白球”的事件为B,
“第i次取到白球”为Ai,i=1,2,3,4,5,
因为甲先取,所以甲只有可能在第1次,第3次和第5次取球.
所以P(B)=P(A1+A3+A5).
因此A1,A3,A5两两互斥,
∴P(B)=P(A1)+P(A3)+P(A5)
=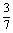 +
+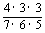 +
+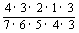
=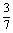 +
+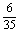 +
+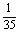 =
=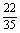 .
.
10. 箱中有a个正品,b个次品,从箱中随机连续抽取3次,在以下两种抽样方式下:(1)每次抽样后不放回;(2)每次抽样后放回.求取出的3个全是正品的概率.
解 (1)若不放回抽样3次看作有顺序,则从a+b个产品中不放回抽样3次共有A 种方法,从a个正品中不放回抽样3次共有A
种方法,从a个正品中不放回抽样3次共有A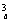 种方法,可以抽出3个正品的概率P=
种方法,可以抽出3个正品的概率P=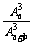 .若不放回抽样3次看作无顺序,则从a+b个产品中不放回抽样3次
.若不放回抽样3次看作无顺序,则从a+b个产品中不放回抽样3次
共有C 种方法,从a个正品中不放回抽样3次共有C
种方法,从a个正品中不放回抽样3次共有C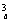 种方法,可以取出3个正品的概率P=
种方法,可以取出3个正品的概率P= .两种方法结果一致. (2)从a+b个产品中有放回的抽取3次,每次都有a+b种方法,所以共有(a+b)3种不同的方法,而3个全是正品的
.两种方法结果一致. (2)从a+b个产品中有放回的抽取3次,每次都有a+b种方法,所以共有(a+b)3种不同的方法,而3个全是正品的
抽法共有a3种,所以3个全是正品的概率
P=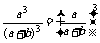 .
.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com