
3.卤素的特殊性
(1)碘单质遇淀粉显示出蓝色,该性质可用于检验Cl2,Cl2可使湿润的KI淀粉试纸变蓝,实质是:Cl2+2I-===I2+2Cl-。I2再作用于淀粉显示出蓝色,另外碘单质还易升华。
(2)氢氟酸能腐蚀玻璃(4HF+SiO2===SiF4↑+2H2O),因此,氢氟酸必须保存在塑料试剂瓶中,制备HF时,反应必须在铅制器皿中进行。
(3)氯气具有漂白性,其实质是Cl2与H2O反应生成的次氯酸(HClO)具强氧化性使有机色质褪色,次氯酸是一种强氧化性的弱酸。
2.卤素化学性质的相似性和递变性
(1)卤素是典型的非金属元素,其元素的非金属性强弱顺序为:F>Cl>Br>I
(2)卤素单质均是氧化剂,其氧化能力强弱顺序为:F2>Cl2>Br2>I2
(3)卤离子均具还原性,其还原性强弱顺序为:I->Br->Cl->F-
(4)卤素单质均能与氢化合,但反应条件不同,生成的气态氢化物稳定性亦不相同。
F2+H2 2HF H2+Cl2
2HF H2+Cl2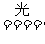 2HCl Br2+H2
2HCl Br2+H2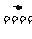 2HBr I2+H2
2HBr I2+H2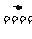 2HI
2HI
气态氢化物稳定性大小顺序为:HF>HCl>HBr>HI
(5)卤素单质均可与水反应,但反应难易程度不同。
2F2+2H2O===4HF+O2↑(剧烈反应)
Cl2+H2O===HCl+HClO(反应较慢)
2HClO===2HCl+O2↑
Br2+H2O===HBr+HBrO(反应微弱)
I2与H2O只有很微弱的反应。
(6)卤素单质可与碱溶液发生自身氧化还原反应生成-1价卤化物和+1价或+5价卤酸盐。
Cl2+2NaOH===NaCl+NaClO+H2O

3Br2+6NaOH===5NaBr+NaBrO3+3H2O
(7)AgX除AgF外均不溶于水,不溶于酸。
(8)AgCl、AgBr、AgI均不稳定,见光发生分解反应,生成卤素单质及银。
2AgX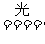 2Ag+X2
2Ag+X2
(9)氢卤酸的水溶液均呈酸性,除HF是弱酸外,其余均为强酸,其酸性相对强弱顺序为:HI>HBr>HCl>HF。
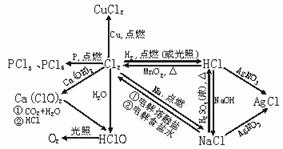
1.氯气及其化合物间的转化关系
氯的代表性中包含了卤素的相似性,掌握了氯气及其化合物的性质,就能推广出卤素的相似性,这是学好卤素的关键。有关氯气及其化合物的相互转化关系见下表:
22.答案:BrO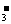 +5Br-+6H+===3Br2+3H2O m/80 氧化 m/16 Br-
+5Br-+6H+===3Br2+3H2O m/80 氧化 m/16 Br-
解析:根据同一元素不同价态间反应可生成中间价态的物质得出反应式;然后利用相对分子质量及化学计量数可顺利解决此问题。
●命题趋向与应试策略
21.答案:(1)HCl (2)Cl2+2NaOH===NaCl+NaClO+H2O

解析:本题综合考查了氯气的性质、电解饱和食盐水、氨气的合成等三个方面的内容,是MCE94无机框图题的再现,但难度有所下降,解决此题的关键是氯气的性质的应用,知道氯气与NaOH反应有三种产物,与H2反应有一种产物,本题即可突破。解此题另一关键点是题目所给的一组数据,由此推出C、D、I反应的化学计量数之比,从而得出该反应为合成氨反应。定性判断与定量推断相结合解无机框图题是今后命题的一个方向。
20.答案:合格
解析:I2+2S2O ===2I-+S4O
===2I-+S4O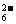
n(I2)=0.03 mol·L-1×0.018 L×1/2=0.27×10-3 mol
IO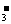 +5I-+6H+===3I2+3H2O
+5I-+6H+===3I2+3H2O
n(KIO3)=0.27×10-3 mol×1/3=0.09×10-3 mol
每千克食盐中含KIO3: ×1000 mg·g-1=45 mg
×1000 mg·g-1=45 mg
所以该加碘食盐是合格的。
19.答案:NaCl为8.700 g,KBr为0.500 g,CaCl2为0.800 g
解析:设混合物中各物质的质量:NaCl为x,KBr为y,CaCl2为z。
x+y+z=10.000 g ①
2KBr+Cl2===2KCl+Br2
混合物中KBr转化为KCl,灼烧后溴全部挥发,因此:
x+ y+z=9.813 g ②
y+z=9.813 g ②
①式-②式得:(1- )y=10.000 g-9.813
g
)y=10.000 g-9.813
g
解得:y=0.500 g
残留物溶于水后加入足量碳酸钠溶液,发生如下反应:
CaCl2+Na2CO3===CaCO3↓+2NaCl
从所得CaCO3的质量可以算出CaCl2的质量:z=0.721 g×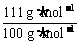 =0.800 g
=0.800 g
氯化钠的质量为:x=10.000 g-0.500 g-0.8000 g=8.700 g。
18.答案:(1)Cl(或氯) K(或钾)
(2)Cl2+2KOH===KCl+KClO+H2O
(3)2KClO3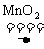 2KCl+3O2↑
2KCl+3O2↑
解析:此题的突破口是:室温下单质A与某种常见一元强碱溶液反应,可得到B和C,且A、B、C中都含有X,说明A中碱中发生了歧化反应,常温下能与碱溶液发生歧化反应的在中学化学中主要是Cl2、Br2等,这就缩小了思考的范围。再结合其他条件从而找出答案。
17.答案:BD
解析:漂白粉的有效成分是次氯酸钙,因而否定A;使淀粉变蓝的是碘的单质,否定C。
16.答案:B
解析:假设95 mg MgCl2粉末中无杂质
MgCl2-2AgCl
95 2×143.5
生成沉淀应为287 mg,小于300 mg,则杂质是含氯量较高的物质。
A.NaCl: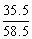 B.AlCl3:
B.AlCl3: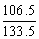 =
=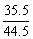 C.KCl:
C.KCl: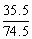 D.CaCl2:
D.CaCl2: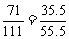
MgCl2: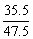 其中B的含氯量高于MgCl2的含氯量。
其中B的含氯量高于MgCl2的含氯量。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com