
11、等电子原理 CO与N2 、CO2与N2O
10、共价键的参数:键长、键能、键角 (键长越短、键能越大分子越稳定)
9、离子键、共价键、金属键
用电子式表示下列物质:Cl2、N2、CH4、NH3、、H2O、HCl、NaOH、MgO、CaCl2、Na2O2、CO2、NH4Cl、C2H4、CH3CH2OH (用结构式表示上述物质中的共价分子)
8、第一电离能、电负性变化:
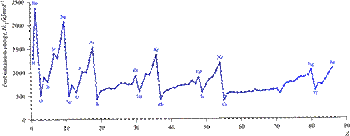
元素第一电离能的周期性
7、元素周期律:核外电子排布、原子半径、化合价、第一电离能、电负性、元素金属性、非金属性、碱性、酸性、氢态氢化物的稳定性等的递变规律
6、 元素周期表分区:s区、p区、d区;金属区、非金属区、半导体区
元素周期表分区:s区、p区、d区;金属区、非金属区、半导体区
5、元素周期表的结构“三短三长一未完,七主七副零IIIV族”
4、能量最低原理、洪特规则、洪特规则特例。
3、构造原理、1-36号元素核外电子排布 (重点:Cr、Mn、Fe、Cu、N、O、Al等)
2、能层、能级、各能层的能级数、各能级的轨道数、各电子层最多容纳的电子数
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com