
2.自然界的固氮是把 态的氮转化为 态的氮,如把 转化为一氧化氮。方程式 。
1.氮气的结构和物理性质:氮气在空气中约占总体积的 。氮气是无色无味的气体,难溶于水。氮气的电子式 ,结构式为 。氮气的化学性质不活泼,其原因是 。所以氮气可做保护气。但在一定条件下,可与氢气、氧气反应,方程式 。
(三)卤素单质的化学性质(相似性及递变性)
由于最外层均为 个电子,极易 电子,因此卤素都是 剂,在自然界均只以 态存在.但随着电子层数递增,原子半径渐 ,核对外层电子的引力渐 ,得电子能力渐 ,其氧化性逐渐 ,主要表现:
。
试题枚举
[例1]下列有关氯的叙述中正确的是
A.液氯和氯水是同一物质
B.红磷在氯气中燃烧产生白色烟雾
C.氯气与水的反应中氯是氧化剂,水是还原剂
D.用氯制漂白粉是为了得到易贮存的漂白剂
解析:液氯、氯水都是液体,但前者是纯氯,后者是氯与水的混合物,时间延长氯水中还逐渐生成盐酸和次氯酸,氯分子渐少,氯离子渐多。如果再有光照, 因分解也在渐少,出现氧气和更多盐酸。氯与水的反应是氯分子中氯原子间发生的自身氧化还原,即歧化反应, 水虽然是反应物,却未参加氧化还原。A、C不正确。
烟是分散在气体中的固体小颗粒,雾是分散在气体里的液体小珠滴。磷在氯气里燃烧的产物三氯化磷是无色液体,可发雾;五氯化磷是浅黄色固体,能形成烟。漂白粉和氯都可以作为漂白剂、消毒剂,且氯更有效。但氯气难贮存,又有剧毒,一般医用、家用的漂白剂和消毒剂使氯气是不合宜的,所以制成漂白粉便于贮存和使用。漂白粉保存得当,如密闭,以防止吸水和 而变质,可以存放较长时间。B、D正确。
答案:B、D。
[例2] 潮湿的氯气、新制的氯水、次氯酸钠及漂白粉的水溶液均能使有色布条褪色,原因是它们均含有 ( )
A. 氯气 B. 次氯酸 C. 次氯酸根 D. 氯化氢
解析 NaClO及Ca(ClO)2的水溶液中,ClO-水解产生HClO无HCl;有色布条的褪色是因HClO的氧化所致。
答案: B
[变式] 用滴管将新制的氯水慢慢滴入盛酚酞的氢氧化钠稀溶液中,当滴到最后一滴时红色突然褪去,发生这一现象的原因可能有两个:
①是由于 (用简要文字说明)
②是由于 (用简要文字说明)
简述用实验方法证明褪色的原因是①还是②
。
[例3]如何鉴别NaCl、NaBr、KI三种白色固体?
解答:
方法一:可用氯水鉴别。
把这三种物质各取少量制成溶液,加入新制的氯水和汽油(或四氯化碳),振荡,分层,使汽油层呈无色的是NaCl;使汽油层呈橙色的是NaBr;呈紫色的是KI。
方法二:可先用焰色反应将KI区分出来。然后再将另外两种物质各取少量制成溶液,加入AgNO3溶液,有白色沉淀生成的是NaCl,有浅黄色沉淀生成的是NaBr。
方法三:直接加入AgNO3溶液。
分别取少量固体制成溶液,分别加入AgNO3溶液,有白色沉淀生成的是NaCl,有浅黄色沉淀生成的是NaBr,有黄色沉淀生成的是KI。
[例4] 多原子分子氰(CN)2、硫氰(SCN)2和(OCN)2的性质与卤素单质相似,故称它们为拟卤素。它们可以生成酸和盐(见下表,表中X代表F、Cl、Br或I)。
|
|
卤素 |
氰 |
硫氰 |
① |
|
“单质” |
X2 |
(CN)2 |
(SCN)2 |
(OCN)2 |
|
酸 |
HX |
HCN |
② |
HOCN |
|
盐 |
KX |
KCN |
KSCN |
③ |
(1)在表中①②③空格处应分别填写_______、_______、_______。
(2)完成下列反应的化学方程式或离子方程式。
①(CN)2和KOH溶液反应的化学方程式为:______________。
②已知阴离子的还原性强弱为:Cl-<Br-<CN-<SCN-<I-。试写出在NaBr和KSCN的混合溶液中加入(CN)2反应的离子方程式:____________________________________。
解析:此题主要考查“运用已学知识进行类推思维的能力”。解题时可用熟知的Cl2、HCl、KCl等物质作参照物。由还原性Br-<CN-<SCN-,可推知氧化性Br2>(CN)2>(SCN)2,因而可判断(CN)2只能与KSCN反应,不能与NaBr反应,亦即由物质的氧化性和还原性的强弱,可以判断氧化还原反应能否发生。
答案:(1)氧氰 HSCN KOCN
(2)①(CN)2+2KOH====KCN+KOCN+H2O
②(CN)2+2SCN-====2CN-+(SCN)2
该题为信息给予题,给予的信息是:拟卤素(如(CN)2)的性质与卤素单质相似,由此而可依据卤素单质的性质来进行类比、模拟来解答习题。这是解答信息给予题的一种方法。
[变式] 溴化碘(IBr)的化学性质与卤素单质相似,能与大多数金属反应生成金属卤化物,和某些非金属单质反应生成相应的卤化物,跟水反应的方程式IBr+H2O=HBr+HIO,下列有关IBr的叙述中,不正确的是 ( )
A. IBr是双原子分子
B.在很多反应中IBr是强氧化剂
C.和NaOH溶液反应生成NaBr和NaIO
D.和水反应时,既是氧化剂又是还原剂
 [例5]在右图的四条直线分别表示钠、镁、铝、铁与足量Cl2反应时,消耗金属的质量(纵轴)与反应掉的氯气质量(横轴)的关系,其中代表铁与Cl2反应的直线是 ( )
[例5]在右图的四条直线分别表示钠、镁、铝、铁与足量Cl2反应时,消耗金属的质量(纵轴)与反应掉的氯气质量(横轴)的关系,其中代表铁与Cl2反应的直线是 ( )
A. a B. b C. c D. d
解析 Cl2与四种金属反应的均为氧化还原反应,在横坐标上取一点作一条垂直于横坐标的直线,分别与a、b、c、d四条直线的交点即为四种金属与等质量Cl2反应时所需的质量。假设这一点的质量为35.5g,此时金属均转移1mol电子,则消耗四种金属的质量分别为:WNa=23g、WMg=12g、WAl=9g、WFe=18.7g,即等质量氯气消耗四种金属的质量是WNa>WFe>WMg>WAl,故a、b、c、d分别代表Al、Mg、Fe、Na与氯气的反应。
答案:C
氮及其化合物
考点聚焦
1. 知道氮气的物理性质及存在。
2. 能从氮气的结构理解其化学性质。
3. 掌握氮氧化物的重要性质,知道氨的物理性质和用途,掌握氨与水、HCl、O2等的反应。了解氨水的成分及不稳定性。
4. 了解铵盐易溶于水、受热易分解、与碱反应。知道NH4+的检验方法。
5. 掌握氨气的实验室制法。
6. 了解硝酸的化学性质。
知识梳理
(二)单质的物理性质
随卤素核电荷数增加,其原子结构的递变而使卤素单质的物理性质呈规律性变化.
归纳:从F2 →I2
1、颜色逐渐 ,状态从 → → ,密度从 → ,熔沸点由 → (原因是 。
2、单质的溶解性--除氟外(与水剧烈反应)在水中溶解度都较 ,且由 → ,都易溶于有机溶剂,下表列出Cl2、Br2、I2在不同溶剂中的颜色.
|
|
水 |
CCl4 |
|
|
Cl2 |
|
|
|
|
Br2 |
|
|
|
|
I2 |
|
|
|
(一)卤素的原子结构
共同点:原子的最外层均为 个电子,都易 1个电子而表现 性;
不同点:核电荷数逐渐 ;电子层数逐渐 ;原子半径依次 ,得电子能力逐渐 ;单质氧化性逐渐 。
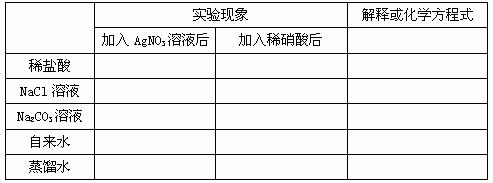
2、原理:被检液中滴入少量 酸化,再滴入 溶液,若产生 ,则可断定溶液中含有氯离子。不可用盐酸酸化,酸化目的是防止( 、 、 、 )影响。
+ AgNO3(aq) → + 稀硝酸 →白色↓
解释:Ag+ + Cl- = AgCl↓
2Ag+ + CO32- = Ag2CO3↓ Ag2CO3 + 2H+ = 2Ag+ + H2O + CO2↑
1、填写下列表格:
2、氯气的化学性质
由氯的原子结构示意图可知氯元素的性质如何?进而能否预测氯气的化学性质又怎样?为什么? 。
① 与金属单质的反应:与钠反应方程式 。现象是 。与
铁反应方程式 。现象是 。与铜反应方程式 。现象是 。
② 与氢气的反应:化学方程式: ,反应现象:氢气在氯气中燃烧 ;氯气与氢气的爆炸实验 。
③Cl2 和红磷反应:化学方程式: ,反应现象 。
结论:分析以上反应中氯元素价态的变化也可得知:氯气是一种强氧化性物质,常氧化剂。
思考:在初中我们是如何定义燃烧的?现在通过氢气与氯气的燃烧实验,你有什么新的认识?
④与水的反应:
与水反应的离子方程式: ,说明:氯气与水反应很微弱,且未可逆反应。
思考:1、氯水的成分 ?(氯水参加反应时,能表现多种性质)2、氯水的保存方法?
⑤次氯酸的性质:
a、一元弱酸(比 弱)
b、强氧化性( 、 、 )
c、不稳定(见光或受热分解):化学方程式: 。
⑥与碱的反应
Cl2 + _NaOH -- 。(常用于除去多余氯气)
离子方程式: 。漂白液主要成分是 。
漂白粉的制法: 。其主要成分: ,有效成分: 。漂粉精的有效成分: 。
漂白原理:ClO-+ H+ = HClO(实际漂白者),Ca(ClO)2 +_HCl(稀)= 。
Ca(ClO)2 +CO2 +H2O = 。
思考:抗洪救灾中防疫部门,向灾民发放的漂白粉片或漂粉精用于饮用水消毒。漂粉精为何要密封保存在阴暗处?
1、氯气的物理性质: 色有 气味的 体, 毒, 溶于水。实验室中应怎样闻气体: 。
氯元素位于周期表__周期__族,在自然界中的主要存在形态: 。全球海洋中含盐 左右,主要为 、 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com