
1、向饱和的Na2CO3溶液中通足量的CO2有晶体NaHCO3析出。
3、碳酸钠和碳酸氢钠
|
性质 |
Na2CO3(Na2CO3·10H2O) |
NaHCO3 |
性质比较 |
|
俗称 |
纯碱或苏打 |
小苏打 |
NaHCO3的颗粒比Na2CO3小 |
|
水溶性 |
易溶于水 |
易溶于水 |
S(Na2CO3)>S(NaHCO3) |
|
溶液酸碱性 |
显碱性 |
显碱性 |
同浓度Na2CO3溶液的pH大于NaHCO3溶液的pH |
|
热稳定性 |
稳定 |
受热分解生成Na2CO3、H2O、CO2 |
NaHCO3的热稳定性比Na2CO3差,用于除杂质。 |
|
与酸反应 |
能与强酸反应 |
能与强酸反应 |
等物质的量时Na2CO3耗酸量大于NaHCO3 |
|
溶液中相互转化 |
Na2CO3溶液能吸收CO2转化为NaHCO3 Na2CO3 + H2O + CO2 == 2 NaHCO3 |
除CO2中的HCl杂质是用饱和的NaHCO3溶液,而不用Na2CO3溶液 |
|
|
用途 |
用在玻璃、肥皂、合成洗涤剂、造纸、纺织、石油、冶金等工业中。 |
发酵粉的主要成分之一;制胃酸过多等。 |
|
注意几个实验的问题:
2、氧化钠和过氧化钠
(1)Na2O:白色固体,是碱性氧化物,具有碱性氧化物的通性:Na2O + H2O == 2NaOH,
Na2O + CO2 == Na2CO3,Na2O + 2HCl == 2NaCl + H2O .另外:加热时,2Na2O + O2 == 2Na2O2.
(2)Na2O2:淡黄色固体是复杂氧化物,易与水、二氧化碳反应放出氧气。
2Na2O2 + 2H2O == 4NaOH + O2 ↑,2Na2O2 + 2CO2 == 2Na2CO3 + O2 ↑(作供氧剂)。
因此Na2O2常做生氧剂,同时,Na2O2还具有强氧化性,有漂白作用。如实验:Na2O2和水反应后的溶液中滴加酚酞,变红后又褪色,实验研究表明是有:Na2O2 + H2O == 2NaOH + H2O2,2H2O2 == 2H2O + O2 反应发生。因为H2O2也具有漂白作用。当然过氧化钠也可以直接漂白的。
1、钠
 (1)钠的物理性质:钠是银白色金属,密度小(0.97g/cm3),熔点低(97℃),硬度小,质软,可用刀切割。钠通常保存在煤油中。是电和热的良导体。
(1)钠的物理性质:钠是银白色金属,密度小(0.97g/cm3),熔点低(97℃),硬度小,质软,可用刀切割。钠通常保存在煤油中。是电和热的良导体。
(2)钠的化学性质:从原子结构可知钠是活泼的金属单质。
①钠与非金属单质反应:常温:4Na
+ O2 ==
2Na2O,加热:2Na
+ O2  Na2O2;
Na2O2;
2Na + Cl2
 2NaCl; 2Na + S
2NaCl; 2Na + S  Na2S等。
Na2S等。
②钠与水反应:2Na + 2H2O == 2NaOH + H2↑;实验现象:钠浮在水面上,熔成小球,
在水面上游动,有哧哧的声音,最后消失,在反应后的溶液中滴加酚酞,溶液变红。
注意:钠在空气中的变化:银白色的钠 变暗(生成了氧化钠)
变暗(生成了氧化钠) 变白(生成氢氧化钠)
变白(生成氢氧化钠) 潮解
潮解 变成白色固体(生成碳酸钠)。
变成白色固体(生成碳酸钠)。
③钠与酸反应:如2Na + 2HCl == 2NaCl + H2↑,Na放入稀盐酸中,是先与酸反应,酸不足再与水反应。因此Na放入到酸溶液中Na是不可能过量的。同时Na与H2的物质的量比始终是2:1。当然反应要比钠与水的反应剧烈多。
④钠与盐的溶液反应:钠不能置换出溶液中的金属,钠是直接与水反应。反应后的碱再与溶液中的其他物质反应。如钠投入到硫酸铜溶液的反应式:2Na + CuSO4 + 2H2O == Cu(OH)2 ↓+ Na2SO4 + H2 ↑。
⑤钠与氢气的反应:2Na + H2 == 2NaH。NaH + H2O == NaOH + H2 ↑;NaH是强的还原剂。
(3)工业制钠:电解熔融的NaCl,2NaCl(熔融)  2Na + Cl2↑。
2Na + Cl2↑。
(4)钠的用途:①在熔融的条件下钠可以制取一些金属,如钛、锆、铌、钽等;
②钠钾合金是快中子反应堆的热交换剂;
③钠蒸气可作高压钠灯,发出黄光,射程远,透雾能力强。
2. 性质: 。
试题枚举
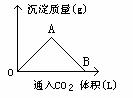 [例1]右图为一定量饱和Ca(OH)2溶液中通入CO2气体后,产生CaCO3白色沉淀的质量与CO2体积的关系曲线,试回答:
[例1]右图为一定量饱和Ca(OH)2溶液中通入CO2气体后,产生CaCO3白色沉淀的质量与CO2体积的关系曲线,试回答:
(1)OA段曲线与AB段曲线所表示的反应方程式为OA:__________,AB_____________。
(2)A点已参加反应的CO2和Ca(OH)2的物质的量之比为______________。
(3)B处溶液中存在的浓度较大的两种离子是_______和________(填离子符号),将B处生成的溶液煮沸可见到的现象是_______________
解析:CO2与Ca(OH)2反应,CO2的量直接影响产物的生成,图形较清楚地反映了这一关系,依据有关反应原理:
CO2(少)+Ca(OH)2== CaCO3↓+H2O ,
AB段:CO2+CaCO3+H2O== Ca(HCO3)2
便可判断图形中各段所发生的反应,OA段随着CO2继续通入CaCO3的量逐渐增大,A点达到沉淀最大值,AB段随CO2的继续通入,生成的CaCO3不断溶解转化为Ca(HCO3)2,B点CaCO3全溶解,溶液又变得澄清。
答案:(1)OA段:CO2+Ca(OH)2== CaCO3↓+H
AB段:CO2+CaCO3+H2O== Ca(HCO3)2
(2)A点:n(CO2)∶n[Ca(OH)2]=1∶1
(3)Ca2+ HCO3- 因Ca(HCO3)2受热分解,溶液变浑浊,有气泡逸出。
[例2]下列关于硅的说法不正确的是 ( )
A.硅是非金属元素,但它的单质是灰黑色有金属光泽的固体
D.硅的导电性能介于金属和绝缘体之间,是良好的半导体材料
C硅的化学性质不活泼,常温下不与任何物质起反应
D.当加热到一定温度时,硅能与氧气、氢气等非金属反应
解析: 常温下,硅可与氟气、氢氟酸、强碱溶液反应,加热和高温条件下,硅能与氧气、氢气起反应。选C。
答案: C
[例3]石墨炸弹爆炸时能在方圆几百米范围内撒下大量石墨纤维,造成输电线、电厂设备破坏。这是由于石墨( )
A . 有放射性 B. 易燃、易爆 C. 能导电 D. 有剧毒
解析:利用了石墨的导电性能,石墨纤维落在输电线上,造成线路短路,发电机和其他设施损坏。石墨性质稳定,无毒也不易燃、易爆。
答案: C
1. 制法: 。
3.化学性质:(1)酸性氧化物:与强碱反应:
离子方程式: (保存碱性溶液不能用橡胶塞)。与碱性氧化物反应: 。
(2)与HF反应: (唯一与其反应的酸)。
4,用途:(1)制造光导纤维
(2)石英坩埚
(3)光学仪器和工艺品
2.结构:一个硅原子与4个氧原子形成4个共价键,即每个硅原子周围有4个氧原子,每个氧原子周围有2个硅原子;晶体中硅原子和氧原子以1:2组成空间立体网状结构,是原子晶体。
1.存在:天然SiO2也叫硅石,自然界中的石英玛瑙(含杂质的石英)的主要成分都是SiO2。。
5.用途:(1)良好的半导体材料(为什么?)
(2)太阳能电池
(3)计算机芯片
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com