
4.元素周期律
|
涵
义 |
元素性质随着元素原子序数的递增而呈周期性变化。 |
|
实
质 |
元素性质的周期性递变是核外电子排布周期性变化的必然结果。 |
|
核外电 子排布 |
最外层电子数由1递增至8(若K层为最外层则由1递增至2)而呈现周期性变化。 |
|
原子半径 |
原子半径由大到小(稀有气体元素除外)呈周期性变化。原子半径由电子层数和核电荷数多少决定,它是反映结构的一个参考数据。 |
|
主 要 化 合 价 |
最高正价由+1递变到+7,从中部开始有负价,从-4递变至-1。(稀有气体元素化合价为零), 呈周期性变化。元素主要化合价由元素原子的最外层电子数决定,一般存在下列关系: 最高正价数=最外层电子数 |
|
元素及化合物的性质 |
金属性渐弱,非金属性渐强,最高氧化物的水化 物的碱性渐弱,酸性
渐强,呈周期性变化。这是由于在一个周期内的元素,电子层数相同,最外层电子数逐渐增多,核对外层电子引力渐强,使元素原子失电子渐难,得电子渐易,故有此变化规律。 |
3. 原子核外电子排布规律
|
核 外电 子 排 布 规 律 |
1 |
各电子层最多能容纳2n2个电子 即:电子层序号 1 2 3 4 5 6 7 代表符号 K L M N O P Q 最多电子数 2 8 18 32 50 72 98 |
|
|
2 |
 最外层电子数目不超过8个(K层为最外层时不超过2个)。 最外层电子数目不超过8个(K层为最外层时不超过2个)。 |
||
|
3 |
次外层电子数最多不超过18个,倒数第三层不超过32个。 |
||
|
4 |
核外电子总是尽先排满能量最低、离核最近的电子层,然后才由里往外,依次排在能量较高,离核较远的电子层。 |
||
|
注 意 事 项 |
1. 以上几点是相互联系的,不能孤立地理解,必须同时满足各项要求。 2. 上述乃核外电子排布的初步知识,只能解释1-18号元素的结构问题,若要解释更多问题,有待进一步学习核外电子排布所遵循的其它规律。 |
||
|
原 子 结 构 的 表 示 方 法 |
原子结构示意图和离子结构示意图 |
要理解图中各符号的含义。例:氯原子, 圆圈内表示原子的质子数,要注意正号;弧线表示电子层, 弧线内数字表示该层中的电子数。 圆圈内表示原子的质子数,要注意正号;弧线表示电子层, 弧线内数字表示该层中的电子数。离子结构示意图中各符号含意一样,但注意原子结构示意图中质子数等于核外电子数,而离子结构示意图中质子数与核外电子数不相等。如Cl-: 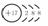 |
|
|
电子式 |
电子式是在元素符号周围用小黑点或电子式是在元素符号周围用小黑点或“×”的数目表
示该元素原子的 最外层电子数的式子。小黑点或“×”的数目即为该原子的最外层电子数。如 a、 a、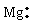 、. 、. l. 、 l. 、 、. 、.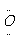 . .,: 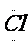 . 、: . 、: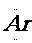 : : |
||
2.同位素及相对原子质量
|
同 位 素 |
定义 |
具有相同质子数和不同中子数的同一元素的原子互称同位素 |
|
特性 |
1.
同一元素的各种同位素化学性质几乎完全相同. 2. 天然存在的某种元素里,不论是游离态还是化合态,各种同位素的原子含量一般是不变的. |
|
|
判定 方法 |
它反映的是同种元素的不同原子间的关系.故单质、化合物间不可能是同位素。如H2和D2及H2O和D2O之间不存在同位素关系。只有质子数相同而中子数不同的原子才是同位素;如168O和188O是同位素,而且146C和147N不是同位素。 |
|
|
注意 |
天然存在的元素中,许多都有同位素(但并非所有元素都有同位素)。因而发现的原子种数多于元素的种数。 |
|
|
相对原子质量和近似相对原子质量 |
同位素的相对原子质量和近似相对原子质量 |
按初中所学的相对原子质量的求算方式是:一个原子的质量与一个12C原子质量的 的比值。显然,所用原子质量是哪种同位素原子的质量,其结果只能是该同位素的相对原子质量。故该定义严格说应是同位素的相对原子质量。该比值的近似整值即为该同位素的近似相对原子质量,其数值等于该同位素的质量数。 的比值。显然,所用原子质量是哪种同位素原子的质量,其结果只能是该同位素的相对原子质量。故该定义严格说应是同位素的相对原子质量。该比值的近似整值即为该同位素的近似相对原子质量,其数值等于该同位素的质量数。 |
|
元素的相对原子质量和近似相对原子质量 |
因天然元素往往不只一种原子,因而用上述方法定义元素的相对原子质量就不合适了。元素的相对原子质量是用天然元素的各种同位素的相对原子质量及其原子含量算出来的平均值。数字表达式为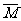 =M1×a1%+M2×a2%+……。若用同位素的质量数替代其相对原子量进行计算,其结果就是元素的近似相对原子质量(计算结果通常取整数)。我们通常采用元素的近似相对原子质量进行计算。 =M1×a1%+M2×a2%+……。若用同位素的质量数替代其相对原子量进行计算,其结果就是元素的近似相对原子质量(计算结果通常取整数)。我们通常采用元素的近似相对原子质量进行计算。 |
1. 原子结构及离子结构中各种基本微粒间的关系

4.以第3周期为例,掌握同一周期内元素性质(如:原子半径、化合价、单质及化合物性质)的递变规律与原子结构的关系;以ⅠA和ⅡA族为例,掌握同一主族内元素性质递变规律与原子结构的关系。
知识梳理
3.掌握元素周期律的实质及元素周期表(长式)的结构(周期、族)。
2.以第1、2、3周期的元素为例,掌握核外电子排布规律。
1.理解原子的组成及同位素的概念。掌握原子序数、核电荷数、质子数、中子数、核外电子数,以及质量数与质子数、中子数之间的相互关系。
2.下列元素中,化学性质和物理性质最像Q元素的是
A 硼(1s22s22p1) B 铍(1s22s2) C 锂(1s22s1)
D 氢(1s1) E 氦(1s2)
解析:R、U的最外层电子数均为1,R和U最可能处于同一族;Q第一电离能很大,可能为0族元素
答案:E E
①原子半径由大到小;
②主要化合价:正价由+1→+7,负价由-4→-1;
③元素性质:同一周期由前往后金属性 ,非金属性 ,同一主族,由上往下金属性 ,非金属性 ;
④电离能: 态电 性基态原子失去 个电子,转化为气态基态正离子所需要的 叫做第一电离能。第一电离能越大,金属活动性越 。同一元素的第二电离能 第一电离能;同一主族,由上往下第一电离能 ,同一周期由前往后电离有 的趋势,但二、三周期中 、 、 和 四种元素的原子第一电离能大于相邻的前后元素的原子,这是因为
⑤电负性:电负性用来描述 ,电负性的大小也可作为 的尺度,在元素周期表中,电负性最大的是 ,金属的电负性一般 1.8;同一周期由前往后电负性 ,同一主族,由上往下电负性 。
试题枚举
[例1]x 、 y为两种元素的原子,x的阴离子与y的阳离子具有相同的电子层结构,由此可知
A. x的原子半径大于y的原子半径。 B. x的电负性大于y的电负性。
C. x 的氧化性大于y的氧化性。 D. x的第一电离能大于y 的第一电离能。
解析:x的阴离子与y的阳离子具有相同的电子层结构,则y原子比x原子多一个电子层,y原子半径大,A项错误;x是非金属,y是金属,非金属的电负性大于金属,B项正确;y单质无氧化性,C错误;x是非金属,y是金属,非金属的第一电离能大于金属,D错误。
答案:B。
[例2]1、某元素的电离能(电子伏特)如下:
|
I1 |
I2 |
I3 |
I4 |
I5 |
I6 |
I7 |
|
14.5 |
29.6 |
47.4 |
77.5 |
97.9 |
551.9 |
666.8 |
此元素位于元素周期表的族数是
A. IA B. ⅡA C. ⅢA D、ⅣA E、ⅥA F、ⅤA G、 ⅦA
解析:由I5→I6电离能发生突跃,可知该元素的原子外层有5个电子。
答案:E。
[例3]应用元素周期律的有关知识,可以预测我们不知道的一些元素及其化合物的性质。下列预测中不正确的是
①Be的氧化物的水化物可能具有两性,②Tl能与盐酸和NaOH溶液作用均产生氢气,③At单质为有色固体,AgAt不溶于水也不溶于稀硝酸,④Li在氧气中剧烈燃烧,产物是Li2O2,其溶液是一种强碱,⑤SrSO4是难溶于水的白色固体,⑥H2Se是无色,有毒,比H2S稳定的气体
A.①②③④ B.②④⑥ C.①③⑤ D.②④⑤
解析:由对角线规律可知Be的化合物性质与Al的化合物性质相似,①对;Tl与Al同一族,金属性比铝强很多,能与盐酸产生氢气,但不能和NaOH溶液作用,②错;卤化银颜色由上往下加深,溶解度减小,③对;Li在氧气中燃烧,产物是Li2O,④错;筛选可知
答案:C
[例4]气态中性基态原子的原子核外电子排布发生如下变化,吸收能量最多的是
A. 1s22s22p63s23p2→1s22s22p63s23p1
B. 1s22s22p63s23p3→1s22s22p63s23p2
C. 1s22s22p63s23p4→1s22s22p63s23p3
D. 1s22s22p63s23p64s24p2→1s22s22p63s23p64s24p1
解析:题中A、B、C、D依次为Si、P、S、Ge ;Si和Ge同一族,Si在Ge上方,第一电离能大;Si、P、S为同一周期相邻元素,P的3p轨道半充满,电子能量较低,第一电离能大。
答案:B
[例5] 12.下列是几种原子的基态电子排布,电负性最大的原子是
A.1s22s22p4 B.1s22s22p63s23p3
C.1s22s22p63s23p2 D.1s22s22p63s23p64s2
解析:题中A、B、C、D依次为O、P、Si、Ga ;O的非金属性最强,电负性最大
答案:A
[例6]根据下列五种元素的电离能数据(单位:kJ/mol),回答下面各题。
|
元素代号 |
I1 |
I2 |
I3 |
I4 |
|
Q |
2080 |
4000 |
6100 |
9400 |
|
R |
500 |
4600 |
6900 |
9500 |
|
S |
740 |
1500 |
7700 |
10500 |
|
T |
580 |
1800 |
2700 |
11600 |
|
U |
420 |
3100 |
4400 |
5900 |
1.在周期表中,最可能处于同一族的是
A Q和R B S和T C T和U D R和T E R和U
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com