
1、下图表示四个国家的人口出生率和人口死亡率,其中人口自然增长率最高的国家是:

A.① B.② C.③ D.④
23.酸、碱、盐是有广泛用途的重要化合物。某化学活动小组的同学围绕这几类化合物进行了一系列的探究活动。
⑴ 同学们打开盛浓盐酸和浓硫酸试剂瓶的瓶盖,立即就能把它们区分开来,这是为什么?
同学们打开盛浓盐酸和浓硫酸试剂瓶的瓶盖,立即就能把它们区分开来,这是为什么?
(2)右图是某试剂瓶标签上的内容。要把10 g这种浓硫酸稀释为20%的硫酸,需要水的质量为 g。稀释浓硫酸时,不可将水倒进浓硫酸里,请解释其原因。
(3)为探究一瓶氢氧化钠固体的变质情况,同学们进行了如下实验。
①取少量该固体样品置于试管中,向其中加入一种无色溶液,发现有气泡产生,说明该样品中含有碳酸钠,由此可确定该固体已发生变质。则无色溶液可能是 。
 ②为探究该固体中是否还有未变质的氢氧化钠,同学们又进行了如下表所示的实验。已知碳酸钠的水溶液呈碱性,它的存在会对氢氧化钠的检验造成干扰。请根据右图部分物质的溶解性表(20℃)所提供的信息,将下表填写完整。
②为探究该固体中是否还有未变质的氢氧化钠,同学们又进行了如下表所示的实验。已知碳酸钠的水溶液呈碱性,它的存在会对氢氧化钠的检验造成干扰。请根据右图部分物质的溶解性表(20℃)所提供的信息,将下表填写完整。
|
实验目的 |
实验操作 |
现象 |
结论或化学方程式 |
|
除去碳酸钠 |
取少量该固体样品溶于水配成溶液,滴加适量的 溶液. 充分反应后过滤 |
有白色沉淀生成 |
有关反应的化学方程式为 |
|
检验是否含有氢氧化钠 |
在滤液中滴加酚酞溶液 |
|
该样品中含有氢氧化钠 |
(4)若73 g质量分数为20%的盐酸与127g氢氧化钠溶液恰好完全中和,试计算反应后所得溶液中溶质的质量分数。
思路方法点拨:本题是一道围绕酸、碱、盐知识的综合应用题,试题的开放性很强,是对考生的科学探究能力、计算能力、分析问题的能力、过程与方法等的综合考查。第⑴小题是对科学探究的过程与方法的考查,打开盛浓盐酸和浓硫酸试剂瓶的瓶盖,立即就能把它们区分开来,是由于探究过程中可以看到瓶口有的有白雾,有的没有,原因是浓盐酸具有挥发性,挥发出氯化氢气体在瓶口与空气中的水蒸气形成盐酸小液滴的缘故。第(2)小题类似下册课本第43页例题2,考查溶液稀释方法和有关计算,根据溶液稀释前后溶质质量不变,(试剂瓶标签上信息知浓硫酸的质量分数为98%)设需要加入水的质量为X:10g×98%=(10g+X)×20% 解之,X=39g 。稀释浓硫酸时,由于水的密度较小,浮在浓硫酸上面,而且浓硫酸溶解时放出的热会使水立刻沸腾,使硫酸液滴向四周飞溅,所以不可将水倒进浓硫酸里。第(3)小题①考查碱的化学性质和分析推理能力,NaOH变质是NaOH和空气中的CO2作用,生成了Na2CO3和H2O,检验NaOH是否变质实际上是检验NaOH中是否含有Na2CO3,酸可以选用HCl,H2SO4等;第(3)小题②要想探究该固体中是否还有未变质的氢氧化钠,根据下表实验步骤,必须先除去碳酸钠,再检验是否还有未变质的氢氧化钠。因此,题目综合分析难度稍高,隐藏了先除杂后检验信息。除去碳酸钠,即把碳酸根转化成气体或沉淀。根据本题情况,若加入酸,把碳酸根转化成气体,会影响下一步对氢氧化钠的检验,所以只能设法把碳酸根转化成沉淀。根据物质的溶解性表信息知,可以加入氢氧化钡或可溶性钡盐。但加入氢氧化钡影响下一步对氢氧化钠的检验,因此只可加入硝酸钡或氯化钡溶液。(注:此题物质的溶解性表中没有钙离子,实际上可溶性钙盐也可以)第(4)小题是对根据化学方程式进行计算和溶液的质量分数的综合能力的考查。
22. (4分)右图是实验室常用的制取气体的装置。
(4分)右图是实验室常用的制取气体的装置。
(1)采用A装置制取气体时,反应物的状态和反应条件需满足什么要求?
(2)B装置可以制取多种气体,请写出制取其中一种气体的化学方程式。
(3)写出可采用C装置(气体由d口进入)收集的一种气体的名称,并用简单的方法验证该气体。
 思路方法点拨:本题属于开放性试题,考查实验室制取气体的原理、装置选用依据、收集和检验方法。第(1)小题A装置的反应物一般为固体,反应条件需要加热;第(2)小题开放性较强,B装置可以制取氧气、二氧化碳、氢气等多种气体:
思路方法点拨:本题属于开放性试题,考查实验室制取气体的原理、装置选用依据、收集和检验方法。第(1)小题A装置的反应物一般为固体,反应条件需要加热;第(2)小题开放性较强,B装置可以制取氧气、二氧化碳、氢气等多种气体:
2H2O2 2H2O + O2↑;CaCO3 + 2HCl == CaCl2 + CO2↑+ H2O;Zn + H2SO4 == ZnSO4 + H2↑。第(3)小题气体由d口进入,排出装置内的空气,要求此气体密度要比空气大,可以是氧气、二氧化碳等;验证氧气的方法是:将带火星的木条伸入其中,木条能够复燃的,说明收集的气体是氧气;验证二氧化碳的方法是:将气体通入澄清石灰水,有浑浊产生的,说明收集的气体是二氧化碳。
21.(3分)物质的用途与其性质密切相关,研究金属的性质可以更好地利用金属。
(1)2009年“拍卖风波”中的兔首和鼠首是青铜器。久置的铜制品表面会锈蚀生成铜绿[Cu2(OH)2CO3],铜绿是铜与空气中的氧气、水和 共同作用的结果。
(2)为探究铝、铁、铜的活动性顺序,某同学设计了一组实验:①铝片浸入稀硫酸中 ②铜片浸入稀硫酸中 ③铝片浸入硫酸亚铁溶液中。 这组实验还不能完全证明三种金属的活动性顺序,请补充一个实验来达到目的(写出实验步骤、现象和化学方程式)。
思路方法点拨:本题结合2009年最新社会事件,考查了金属铜的性质和铝、铁、铜金属活动性顺序的探究。“拍卖风波”本身就具有教育意义,利于激发考生的情感、态度、价值观。第(1)小题根据(质量守恒定律)化学反应前后元素种类不变知,生成物铜绿[Cu2(OH)2CO3],反应物铜与空气中的氧气、水中含有氧、氢、铜元素,没有碳元素,所以缺少一种空气中常见的含碳元素的物质----二氧化碳。第(2)小题步骤①说明: Al (H); ②说明: (H) Cu; ③说明: Al Fe;综合起来:Al (H) Cu,但Fe的位置不明确(可能有(H)前Al后、(H)后、Cu后几种情况)。补充一个实验的目的是确定Fe的位置,可以把Fe投入到酸中,证明Fe在(H)前;或把Fe投入到硫酸铜溶液中,证明Fe在Cu前,即可证明铝、铁、铜金属活动性顺序为:Al Fe Cu。
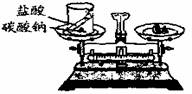 19.(2分)某同学按右图装置对质量守恒定律进行实验探究,结果观察到反应后天平不平衡,由此得出这个化学反应不遵守质量守恒定律的结论。这个结论是否正确?为什么?
19.(2分)某同学按右图装置对质量守恒定律进行实验探究,结果观察到反应后天平不平衡,由此得出这个化学反应不遵守质量守恒定律的结论。这个结论是否正确?为什么?
思路方法点拨:本题考查考生对质量守恒定律的理解,能依据所给事实和实验现象进行正确的解释或说明。此图是课本[实验5-1]的图5-4,给考生以亲切、熟悉的感觉。
20.(3分)请用化学方程式表示下列反应的原理。
(1)天然气(主要成分是CH4)用作燃料。
(2)生石灰用作食品包装袋内的干燥剂。
(3)工业上用碳酸钠溶液和石灰水制取烧碱。
思路方法点拨:本题考查代表物质的重要化学反应的化学方程式的书写。化学方程式的书写要遵守两个原则:一是客观事实,二是质量守恒定律。CH4是最简单的有机物的代表,CH4燃烧生成二氧化碳和水的化学方程式;CaO吸收水生成Ca(OH)2;NaOH是重要工业原料,碱的代表物,工业制取烧碱显得有为重要,河南中招中经常考查。(该题型08年以选择题形式出现过)
18.在实验室里,可以利用右图装置制得铁。
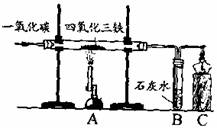 (1)A处玻璃管内所发生反应的化学方程式为
。
(1)A处玻璃管内所发生反应的化学方程式为
。
(2)B处可观察到的现象是 ;C处酒精灯的作用是 。
(3)待四氧化三铁完全反应后,停止加热A处,在断开A、B之前应继续通人一氧化碳至A处玻璃管冷却。若不继续通人一氧化碳.可能出现的后果是 。
思路方法点拨:本题考查科学探究既需要观察和实验,又需要进行推理和判断;工业炼铁原理和实验操作步骤以及注意事项。需要注意:此图并非书上原图、原实验,本题是从四氧化三铁中制得铁。第⑴小题一氧化碳还原氧化铁是河南试卷连续几年都考查过的化学方程式,原因除了工业炼铁的重要性外,还有化学方程式的配平技巧性。第⑵小题B处可观察到的现象是有气泡,产生浑浊,C处酒精灯的作用是点燃过量的一氧化碳,防止污染空气。第(3)小题是对科学探究过程的考查,虽然本实验不要求学生亲自动手,但需要进行理性分析和推理。
17.实验是科学探究的重要途径,请将下列有关实验问题填写完整。
(1)除去O2中少量的CO2,可将混合气体通过足量的 。
(2)除去N a2SO4溶液中少量的N a2CO3,不能选用盐酸的原因是 。
(3)测定稀硫酸的pH时,先用水将pH试纸润湿会使结果偏 (填“大”或“小”)。
思路方法点拨:本题考查除杂试剂的选用和方法和pH的正确使用。除杂的基本原则是:不增(提纯过程中不增加新的物质);不变(被提纯的物质的质量不能减少,原来的状态不能改变);易分(被提纯的物质与杂质易分离)。第⑴小题除去O2中少量的CO2,可将混合气体通过足量的(浓)氢氧化钠溶液,第⑵小题考查对除杂试剂的选用的理解,要用稀硫酸,若用盐酸会生成氯化钠,违背不增原则;第(3)小题先用水将pH试纸润湿,相当于先把酸溶液稀释,酸性减弱,pH越大。
16.“神舟七号”飞船的太空舱里,NiFe2O4可用来促进航天员呼出的CO2转化为O2,而NiFe2O4的质量和化学性质保持不变,则在这个转化过程中NiFe2O4起 作用:航天员出舱行走所穿航天服中的CO2可用LiOH来吸收,已知LiOH与NaOH具有相似的化学性质,则有关反应的化学方程式为 。
思路方法点拨:本题考查催化剂的概念理解和根据信息书写化学方程式的基本能力。随着我国航天事业的不断进步,09年载人航天探空壮举, “神舟”飞船有关舱内知识的考查也成为今年各省市中招的热点。
15.人的胃液里含有适量盐酸。服用含MgCO3 的抗酸药可治疗胃酸过多症,有关反应的化学方程式为 ;该抗酸药说明书上标明的食用方法为“嚼食”,将药片嚼碎后服用的优点是 。
思路方法点拨:抗酸药可治疗胃酸过多症在06、07试卷中以选择题形式考查,用的药物是氢氧化镁,09年改用药物MgCO3以填空题形式考查。同时本题第二空结合化学知识解释 “嚼食”的优点,实质是对化学反应速率的影响因素进行考查。
14.现有下列六种物质:①葡萄糖 ②熟石灰 ③酒精 ④硝酸钾 ⑤硝酸铵 ⑥氯化钠,请从其中选择适当物质的序号填空。可用于改良酸性土壤的是 ;农业上可作复合肥料的是 ;可作为人体重要能量来源的是 。
思路方法点拨:本题考查具有代表性的重要物质在生活、生产、生命活动中的重要作用。熟石灰是氢氧化钙的俗称,属于常见的碱,可用于改良酸性土壤;硝酸钾含有钾、氮元素,属于复合肥;葡萄糖是人体重要能源物质。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com