
14.(2010·宁波模拟)新型纳米材料氧缺位铁酸盐(MFe2Ox)(3<x<4;M表示Mn、Co、Zn或Ni的二价离子),常温下,它能使工业废气中的SO2、NO2等氧化物转化为单质。转化流程如图所示:
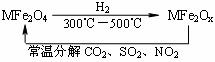
有关上述转化过程的下列叙述正确的是( )。
A.MFe2O4表现了还原性 B.MFe2Ox表现了还原性
C.SO2和NO2表现了还原性 D.SO2和NO2发生了分解反应
[解析]选B。MFe2Ox能使SO2、NO2转化为单质,即SO2→S、NO2→N2,在该转化过程中,硫元素和氮元素的化合价降低,被还原,发生还原反应,作氧化剂,表现氧化性;则MFe2Ox在反应中作还原剂,表现还原性,MFe2O4表现氧化性。
13.(2010·运城模拟)铅的冶炼大致过程如下:①富集:将方铅矿(PbS)进行浮选;②焙烧:2PbS+3O2 2PbO+2SO2;③制粗铅:PbO+C
2PbO+2SO2;③制粗铅:PbO+C Pb+CO;PbO+CO
Pb+CO;PbO+CO Pb+CO2。下列说法正确的是( )。
Pb+CO2。下列说法正确的是( )。
A.浮选法富集方铅矿的过程属于化学变化
B.方铅矿焙烧反应中,PbS是还原剂,还原产物只有PbO
C.整个冶炼过程中,制取1mol Pb共转移2mol电子
D.将1mol PbS冶炼成Pb理论上至少需要6g碳
[解析]选D。浮选法富集方铅矿的过程属于物理变化,A选项错误;方铅矿焙烧反应中,铅元素的化合价没有发生变化,硫元素的化合价升高,被氧化,氧元素的化合价降低,被还原,所以还原剂是PbS,氧化剂是O2,氧化产物是SO2,还原产物是PbO和SO2,B选项错误;整个冶炼过程中的反应物是PbS、O2和C,生成物是Pb、SO2和CO2,总反应方程式为2PbS+3O2+C 2Pb+2SO2+CO2,该反应转移12个电子,所以制取1mol Pb共转移6mol电子,C选项错误;制取1mol Pb需要0.5mol
C,即0.5mol×12g/mol=6g,D选项正确。
2Pb+2SO2+CO2,该反应转移12个电子,所以制取1mol Pb共转移6mol电子,C选项错误;制取1mol Pb需要0.5mol
C,即0.5mol×12g/mol=6g,D选项正确。
12.(2010·辽阳模拟)今有三个氧化还原反应:
①2FeCl3+2KI 2FeCl2+I2+2KCl
2FeCl2+I2+2KCl
②2FeCl2+Cl2 2FeCl3
2FeCl3
③2KMnO4+16HCl 2MnCl2+2KCl+5Cl2↑+8H2O
2MnCl2+2KCl+5Cl2↑+8H2O
若某溶液中有Fe2+、I-和Cl-共存,要氧化除去I-而不影响Fe2+和Cl-,可加入的试剂
是( )。
A.Cl2 B.KMnO4 C.FeCl3 D.HCl
[解析]选C。根据反应①可得氧化性,FeCl3>I2,根据反应②可得氧化性:Cl2>FeCl3,根据反应③可得氧化性:KMnO4>Cl2,则氧化性:KMnO4>Cl2>FeCl3>I2,本题中要氧化I-而不影响Fe2+和Cl-,必须选氧化能力比I2强,而比Cl2弱的氧化剂,只有FeCl3满足条件。
11.(2010·肇庆模拟)在含有FeBr2和FeI2的混合溶液中,通入一定量的Cl2,再滴加KSCN溶液后,溶液变为血红色,则混合溶液中最有可能不存在的离子是( )。
A.Cl- B.Fe2+ C.I- D.Br-
[解析]选C。滴加KSCN溶液后,溶液变为血红色,说明溶液中含有Fe3+,即Fe2+被氧化,因为还原性:I->Fe2+>Br-,所以I-一定全部被氧化,溶液中不可能含有I-。
10.(2010·太原模拟)在下列反应过程中,有3mol电子转移的是( )。
A.lmol钠与水反应
B.27g铝与足量盐酸反应
C.22.4L氧气(标准状况)与足量镁反应
D.1.5mol Na2O2与足量水反应
[解析]选B。先标出每个反应所转移电子数目,然后找出电子数和所给物质之间的关系,即可计算出给定量的物质所转移电子的物质的量。27g铝和标准状况下22.4L氧气的物质的量都是1mol。
|
选项 |
内容指向·联系分析 |
转移电子的物质的量 |
|
A |
2Na+2H2O 2NaOH+H2↑~2e- 2NaOH+H2↑~2e- |
1mol |
|
B |
2Al+6HCl 2AlCl3+3H2↑~6e- 2AlCl3+3H2↑~6e- |
3mol |
|
C |
2Mg+O2 2MgO~4e- 2MgO~4e- |
4mol |
|
D |
2Na2O2+2H2O 4NaOH+O2↑~2e- 4NaOH+O2↑~2e- |
1.5mol |
9.(2010·郑州模拟)为了确定下列物质是否被氧化,所选试剂(括号内物质)达不到实验目的的是( )。
A.FeCl2溶液(KSCN溶液) B.KI溶液(淀粉溶液)
C.HCHO溶液(紫色石蕊试液) D.K2SO3溶液(BaCl2溶液)
[解析]选D。A项,若FeCl2溶液被氧化,溶液中会有Fe3+生成,加入KSCN溶液后溶液变红色;B项,KI溶液被氧化,溶液中会有I2生成,加入淀粉溶液后溶液变蓝;C项,HCHO溶液被氧化,溶液中会有HCOOH生成,加入紫色石蕊试液溶液变红色;D项,无论K2SO3溶液是否被氧化,加入BaCl2溶液后都有白色沉淀生成。
8.(2010·咸阳模拟)根据S2O82-+2e-→2SO42-、Mn2++4H2O→MnO4-+8H++5e-,推测氧化1.5mol Mn2+需S2O82-的物质的量为( )。
A.1.5mol B.3.75mol C.3.25mol D.3.125mol
[解析]选B。根据氧化还原反应得失电子数相等,可以得如下关系式:5S2O82-~10e-~2Mn2+,所以n(S2O82-)= n(Mn2+)=
n(Mn2+)= ×1.5mol=3.75mol。
×1.5mol=3.75mol。
7.(2010·海口模拟)已知几种阴离子还原性强弱顺序为OH-<Cl-<Br-<I-<S2-。若某溶液含有相同浓度的OH-、Cl-、Br-、I-、S2-,当向其中逐滴加入新制的饱和氯水直至过量时,最后被氧化的离子是( )。
A.Br- B.Cl- C.OH- D.S2-
[解析]选A。因为还原性:S2->I->Br->Cl->OH-,所以Cl2先跟还原性最强的
S2-发生置换反应生成S单质,然后再与I-发生置换反应生成I2单质,最后和Br-发生置换反应生成Br2单质。特别注意Cl2不能将Cl-和OH-氧化,否则会错选C。
6.(2010·上海虹口区模拟)已知NH4CuSO3与足量的2mol/L硫酸溶液混合微热,产生下列现象:①有红色金属生成 ②产生刺激性气味的气体 ③溶液呈现蓝色。据此判断下列说法正确的是( )。
A.反应中硫酸作氧化剂
B.NH4CuSO3中硫元素被氧化
C.1mol NH4CuSO3完全反应转移0.5mol电子
D.刺激性气味的气体是氨气
[解析]选C。红色金属是Cu,蓝色溶液中含Cu2+,NH3和SO2都是有刺激性气味的气体,但是NH3能溶于足量的硫酸溶液,所以该气体一定是SO2,由此可写出该反应的方程式:2NH4CuSO3+2H2SO4 (NH4)2SO4+CuSO4+2SO2↑+Cu↓+2H2O,在该反应中铜元素的化合价由+1价变成0价和+2价,所以NH4CuSO3中铜元素既被氧化又被还原,反应转移1个电子,即1mol NH4CuSO3完全反应转移0.5mol电子。
(NH4)2SO4+CuSO4+2SO2↑+Cu↓+2H2O,在该反应中铜元素的化合价由+1价变成0价和+2价,所以NH4CuSO3中铜元素既被氧化又被还原,反应转移1个电子,即1mol NH4CuSO3完全反应转移0.5mol电子。
5.(2010·通辽模拟)某反应体系的物质有:NaOH、Au2O3、Na2S4O6、Na2S2O3、Au2O、H2O。下列选项正确的是( )。

A.Na2S4O6、H2O、Na2S2O3、Au2O、NaOH
B.Na2S2O3、NaOH、Na2S4O6、Au2O、H2O
C.Na2S2O3、H2O、Na2S4O6、Au2O、NaOH
D.当1mol Au2O3完全反应时,转移电子的物质的量为8mol
[解析]选C。Au2O3是反应物,则Au2O一定是生成物,其中Au元素化合价由+3价变成+1价,化合价降低,,则必然有化合价升高的,即Na2S2O3(硫元素为+2价)是反应物,Na2S4O6(硫元素为+2.5价)是生成物。根据反应前后硫元素守恒则有:2Na2S2O3→Na2S4O6,根据钠元素守恒,则生成物这边缺少钠元素,所以NaOH是生成物,再根据氢元素守恒,则水是反应物。由关系式:Au2O3~Au2O~4e-,所以当1mol Au2O3完全反应时,转移电子的物质的量为4mol。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com