
24.答案:(1)SO2 (2)BDF,BCF
解析:本题设置的目的有两个:一是由于题设条件不复杂,看似很容易,易使考生产生轻视题目的心理状态,而不去深入分析而失误。试题通过这种方式体现对考生知识、能力和心理素质的考查;二是因本题作出判断需较大的思维强度,本题的关键在于能否从量上分析H2S和SO2的关系,这就考查了学生思维的深刻性和逻辑性。
从题给条件上首先可判断出不存在的气体是SO2,溶液中Na2CO3和Na2S并存。再由混合溶液与稀H2SO4反应有黄色沉淀的现象,对硫的来源作出两种思考:
其一:H2SO4+Na2S2O3===Na2SO4+S↓+SO2↑+H2O,但反应中有SO2生成,又与前面的判断相矛盾。这就给考生造成了很大的干扰。又因H2SO4+Na2S===H2S↑+Na2SO4。如果能从定量的角度考虑2H2S+SO2===3S↓+2H2O,当n(H2S)=2n(SO2)时,SO2就不会放出了,因此,第一种情况为Na2S、Na2S2O3和Na2CO3。
其二:若用Na2SO3代替Na2S2O3,按上述理由也可由硫产生而无SO2放出,因此第二种情况为:Na2S、Na2SO3和Na2CO3。
若溶液中存在Na2S、Na2SO3、Na2S2O3和Na2CO3也符合现象,但不符合“至少”这一条件。
23.答案:(1)2CO+2NO 2CO2+N2
2CO2+N2
(2)SO2转化为SO3,产生硫酸酸雾 (3)ab
解析:在催化剂作用下把CO和NO都转化为参与大气生态环境循环的无毒气体即NO转化为N2、CO转化为CO2,反应的方程式为2NO+2CO 2CO2+N2。同时SO2也在催化剂的条件下转化为了SO3,从而提高了空气的酸度。控制城市空气的污染源主要是减少煤和汽油的使用。
2CO2+N2。同时SO2也在催化剂的条件下转化为了SO3,从而提高了空气的酸度。控制城市空气的污染源主要是减少煤和汽油的使用。
22.答案:(1)稀氨水和酚酞 稀氨水中的NH3气体逸出,所以溶液的颜色变浅
(2)溶有SO2气体的品红 SO2气体逸出,品红溶液恢复红色
解析:此题考查了学生由实验现象判断实验原理的直觉和逆向思维能力。首先要审清实验的装置为一封闭的体系,受热时,有气体从溶液中逸出进入气球,导致溶液的颜色的变化;冷却后,逸出的气体又溶解在溶液中,得到原来溶液,恢复到原来的溶液的颜色。另外要注意溶液颜色的变化,能使溶液在红色和无色之间变化的物质在中学阶段最常见的是酚酞和品红。导致酚酞溶液在无色和红色之间变化的气体是碱性气体,即氨气;导致品红溶液在无色和红色之间变化的气体是SO2。
21.答案:(1)308 (2)52
(3)设SO2为x(体积分数)则有4×( ×11+0.0800)=1-0.0800-x
×11+0.0800)=1-0.0800-x
x=0.0923
(4)①13b=200-10a ②如下图

解析:(1)1.00
mol FeS2完全氧化需O2为 mol,则需标况下的空气为:
mol,则需标况下的空气为: mol×22.4 L·mol-1÷0.200=308 L
mol×22.4 L·mol-1÷0.200=308 L
(2)采用体积差列式求减少的体积
4FeS2 + 11O2===8SO2+2Fe2O3 ΔV
11 3
55 L×0.200 3
最后气体体积为55 L-3 L=52 L
(3)设SO2为x(体积分数)
则有4×( ×11+0.0800)=1-0.0800-x
x=0.0923
×11+0.0800)=1-0.0800-x
x=0.0923
(4)100 L气体混合物中有N2为(100-a-b) L
而生成b L SO2耗O2为 L
L
则:(100-a-b)∶( +a)=4∶1
+a)=4∶1
即:13b=200-10 a
20.答案:AD

则其物质的量之比为n(H2SO4)∶n(H2O)= =1∶1/9。
=1∶1/9。
即可判断A正确,B、C不正确。D项略作变形:SO3· H2O→SO3·H2O·
H2O→SO3·H2O· H2O→H2SO4·
H2O→H2SO4· H2O,即与A选项相同,故也正确。
H2O,即与A选项相同,故也正确。
19.答案:B
解析:因在某温度下,溶解度为定值,可得方程: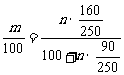 解之得m=
解之得m=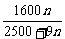 ,选B。(也可由某温度下饱和溶液的溶质的质量分数为一定值列方程:
,选B。(也可由某温度下饱和溶液的溶质的质量分数为一定值列方程: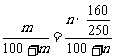 )
)
18.答案:B
解析:Ⅰ.容器内反应后的气体只能为SO2或H2S(因常温水为液态,S为固态),若气体密度大,则应SO2过量,设SO2为5 mol,H2S为1 mol,由方程式2H2S+SO2===3S↓+2H2O知余SO2为4.5 mol,所以密度为4.5×64/20=14.4 g·L-1。
Ⅱ.极限法,假设无H2S,有SO2 5 mol(因此时密度最大),则密度为5×64/20=16 g·L-1,参照选项只能选B。
17.答案:B
解析:此题考查的是硫酸盐的俗名和组成,芒硝的化学式是:Na2SO4·10H2O,明矾的化学式是KAl(SO4)2·12H2O,生石膏的化学式是CaSO4·2H2O,大理石的化学式是CaCO3。
16.答案:A
解析:A项KCl与Br2水不作用,故符合题意。B项反应为H2S+Br2===S↓+2HBr,溴水变浅溶液浑浊。C项CCl4可萃取溴水中的溴,溴水变浅。D项Mg+Br2===MgBr2,溴水褪色。
15.答案:C
解析:酸雨的形成主要是煤和石油的大量使用造成的,开发新能源可以减少对煤的使用,燃料脱硫可以减少SO2的排放量,这些都是可行的。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com