
16.(09全国卷Ⅱ 27)(15分)
27)(15分)

 某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示。
某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示。


 (1)根据左表中数据,在右图中画出X、Y、Z的物质的量(n)随时间(t)变化的曲线:
(1)根据左表中数据,在右图中画出X、Y、Z的物质的量(n)随时间(t)变化的曲线:
|
t/min |
X/mol |
Y/mol |
Z/mol |
|
0 |
1.00 |
1.00 |
0.00 |
|
1 |
0.90 |
0.80 |
0.20 |
|
3 |
0.75 |
0.50 |
0.50 |
|
5 |
0.65 |
0.30 |
0.70 |
|
9 |
0.55 |
0.10 |
0.90 |
|
10 |
0.55 |
0.10 |
0.90 |
|
14 |
0.55 |
0.10 |
0.90 |

 (2) 体系中发生反应的化学方程式是______________;
(2) 体系中发生反应的化学方程式是______________;


 (3) 列式计算该反应在0-3min时间内产物Z的平均反应速率:_______________;
(3) 列式计算该反应在0-3min时间内产物Z的平均反应速率:_______________;

 (4) 该反应达到平衡时反应物X的转化率
(4) 该反应达到平衡时反应物X的转化率 等于___________________________;
等于___________________________;

 (5) 如果该反应是放热反应。改变实验条件(温度、压强、催化剂)得到Z随时间变化的曲线①、②、③(如右图所示)则曲线①、②、③所对应的实验条件改变分别是:
(5) 如果该反应是放热反应。改变实验条件(温度、压强、催化剂)得到Z随时间变化的曲线①、②、③(如右图所示)则曲线①、②、③所对应的实验条件改变分别是:

 ① _________________ ②________________ ③__________________
① _________________ ②________________ ③__________________
 答案:
答案:


 解析:
解析: 本题考查化学反应速率和化学平衡的综合运用,注意图像和有关计算。
本题考查化学反应速率和化学平衡的综合运用,注意图像和有关计算。
 (1)根据题目中表格给出的数据,在坐标系中找出相应的点,然后用光滑的曲线描点即可。
(1)根据题目中表格给出的数据,在坐标系中找出相应的点,然后用光滑的曲线描点即可。
 (2)根据题意,可以利用“三步法”求解
(2)根据题意,可以利用“三步法”求解




 开始 1.00 1.00 0
开始 1.00 1.00 0
 转化 0.45 0.9 0.9
转化 0.45 0.9 0.9
 平衡 0.55 0.1 0.9
平衡 0.55 0.1 0.9
 根据各物质的量之比可得体系中发生反应的化学方程式是:
根据各物质的量之比可得体系中发生反应的化学方程式是:


 。
。
 (3)根据图像可知在3min时,生成物Z的物质的量为0.5mol,
其平均速率为0.083mol/L·min。
(3)根据图像可知在3min时,生成物Z的物质的量为0.5mol,
其平均速率为0.083mol/L·min。
 (4)X的转化率等于0.45。
(4)X的转化率等于0.45。
 (5)由题目所给图象可知,在1中,平衡时Z的物质的量小于原平衡的物质的量,说明平衡逆向移动,条件为升高温度。在2中,平衡时Z的物质的量与原平衡相同,且速率加快,条件为加入催化剂;在3中,平衡正向移动,且速率加快,条件为加压。
(5)由题目所给图象可知,在1中,平衡时Z的物质的量小于原平衡的物质的量,说明平衡逆向移动,条件为升高温度。在2中,平衡时Z的物质的量与原平衡相同,且速率加快,条件为加入催化剂;在3中,平衡正向移动,且速率加快,条件为加压。
15.(09宁夏卷 13)在一定温度下,反应1/2H2(g)+ 1/2X2(g)
13)在一定温度下,反应1/2H2(g)+ 1/2X2(g)  HX(g)的平衡常数为10。若将1.0mol的HX(g)通入体积为1.0L的密闭容器中,在该温度时HX(g)的最大分解率接近于
HX(g)的平衡常数为10。若将1.0mol的HX(g)通入体积为1.0L的密闭容器中,在该温度时HX(g)的最大分解率接近于
 A. 5%
B. 17%
C. 25%
D.33%
A. 5%
B. 17%
C. 25%
D.33%
 答案:B
答案:B

 解析:
解析:
1/2H2(g)+ 1/2X2(g)  HX(g)的平衡常数K1为10,那么HX(g)
HX(g)的平衡常数K1为10,那么HX(g)  1/2H2(g)+ 1/2X2(g) 的平衡常数K2为1/10, 2HX(g)
1/2H2(g)+ 1/2X2(g) 的平衡常数K2为1/10, 2HX(g)  H2(g)+ X2(g) 的平衡常数K3为(1/10)2=0.01.设HX(g)分解xmol/L,有, 2HX(g)
H2(g)+ X2(g) 的平衡常数K3为(1/10)2=0.01.设HX(g)分解xmol/L,有, 2HX(g)  H2(g)+ X2(g)
H2(g)+ X2(g)
 1
0 0
1
0 0
 x
x x
x
x x
 1-x
x x
1-x
x x
 K3= x·x/(1-x) 2= 0.01 ,得到x=0.17,所以, 该温度时HX(g)的最大分解率接近于B. 17%
K3= x·x/(1-x) 2= 0.01 ,得到x=0.17,所以, 该温度时HX(g)的最大分解率接近于B. 17%
14.(09宁夏卷10 )硫代硫酸钠溶液与稀硫酸反应的化学方程式为:Na2S2O3+H2SO4=Na2SO4+SO2+S↓+H2O,下列各组实验中最先出现浑浊的是
)硫代硫酸钠溶液与稀硫酸反应的化学方程式为:Na2S2O3+H2SO4=Na2SO4+SO2+S↓+H2O,下列各组实验中最先出现浑浊的是
|
实验 |
反应温度/℃ |
Na2S2O3溶液 |
稀H2SO4 |
H2O |
||
|
V/mL |
c/(mol·L-1) |
V/mL |
c/(mol·L-1) |
V/mL |
||
|
A |
25 |
5 |
0.1 |
10 |
0.1 |
5 |
|
B |
25 |
5 |
0.2 |
5 |
0.2 |
10 |
|
C |
35 |
5 |
0.1 |
10 |
0.1 |
5 |
|
D |
35 |
5 |
0.2 |
5 |
0.2 |
10 |
答案:D

 解析:影响化学反应速率的因素众多,本题从浓度和和温度两个因素考查,非常忠实于新教材必修2,只要抓住浓度越大,温度越高反应速率越大,便可以选出正确答案D。
解析:影响化学反应速率的因素众多,本题从浓度和和温度两个因素考查,非常忠实于新教材必修2,只要抓住浓度越大,温度越高反应速率越大,便可以选出正确答案D。
13.(09海南卷4 )在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
)在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:

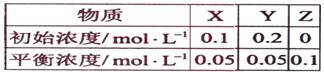
 下列说法错误的是:
下列说法错误的是:



 A.反应达到平衡时,X的转化率为50%
A.反应达到平衡时,X的转化率为50%
 B.反应可表示为X+3Y
B.反应可表示为X+3Y 2Z,其平衡常数为1600
2Z,其平衡常数为1600
 C.增大压强使平衡向生成Z的方向移动,平衡常数增大
C.增大压强使平衡向生成Z的方向移动,平衡常数增大
 D.改变温度可以改变此反应的平衡常数
D.改变温度可以改变此反应的平衡常数
答案:C
解析: 由
aX+ bY  cZ
cZ
初始浓度/mol·L-1 0.1 0.2 0
平衡浓度/mol·L-1 0.05 0.05 0.1
转化浓度/mol·L-1 0.05 0.15 0.1
利用转化浓度之比等于化学计量数比可得到化学方程式为X+3Y 2Z,这样再利用相关数据可得到A、B正确,D因为平衡常数是温度函数而正确。
2Z,这样再利用相关数据可得到A、B正确,D因为平衡常数是温度函数而正确。
点评:本题考查化学反应速率和化学平衡的相关知识。最快捷的方法是利用排除法,抓住化学平衡常数是温度函数,即可得到C错误。
12. (09重庆卷13)各可逆反应达平衡后,改变反应条件,其变化趋势正确的是


答案:D
解析:A项CH3COOH溶液中加入CH3COONa固体,CH3COOH溶液中CH3COO-浓度增加,电离平衡逆向移动,c(H+)减小,pH逐渐增大,A错误;B项加入KCl对平衡体系无影响,化学平衡不移动,B错误;C项恒温恒压,加入Ar,各反应物的物质的量不变,体积变大,各物质的量浓度成倍减小(等效于减压),化学平衡朝体积增大方向移动,H2的改变量减小,起始量不变,转化率减小,C错误;大暗暗选D。
11. (09四川卷13)在一体积可变的密闭容器中,加入一定量的X、Y,发生反应 kJ/mol。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示:
kJ/mol。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示:
 气体体积 气体体积C(Y)/mol·L-1 温度℃ |
1 |
2 |
3 |
|
100 |
1.00 |
0.75 |
0.53 |
|
200 |
1.20 |
0.09 |
0.63 |
|
300 |
1.30 |
1.00 |
0.70 |
下列说法正确的是
A.m>n B.Q<0
C.温度不变,压强增大,Y的质量分数减少
D.体积不变,温度升高,平衡向逆反应方向移动
答案:C
 [解析] 根据题目信息可得,在温度相同的条件下,当体积扩大到原来的两倍时,Y的浓度降低的倍数小于2,所以可确定增大体积,平衡正向移动,根据平衡移动原理,增大体积,平衡向体积增大的方向移动,因此A错误,C项正确。当体积相同时,温度升高,Y的浓度增大,即平衡正向移动,所以此反应的正向为放热反应,B、D错误。
[解析] 根据题目信息可得,在温度相同的条件下,当体积扩大到原来的两倍时,Y的浓度降低的倍数小于2,所以可确定增大体积,平衡正向移动,根据平衡移动原理,增大体积,平衡向体积增大的方向移动,因此A错误,C项正确。当体积相同时,温度升高,Y的浓度增大,即平衡正向移动,所以此反应的正向为放热反应,B、D错误。
[点评] 本题主要通过控制变量讨论化学平衡移动问题,对于学生的基本功要求较高。
本题主要通过控制变量讨论化学平衡移动问题,对于学生的基本功要求较高。
10.(09北京卷9)已知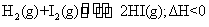 有相同容积的定容密封容器甲和乙,甲中加入
有相同容积的定容密封容器甲和乙,甲中加入 和
和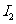 各0.1mol ,乙中加入HI 0.2mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是
各0.1mol ,乙中加入HI 0.2mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是
A.甲、乙提高相同温度 B 甲中加入0.1mol He,乙不改变
C.甲降低温度,乙不变
D 甲增加0.1mol 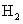 ,乙增加0.1mol
,乙增加0.1mol 
答案:C
 [解析]本题考查化学平衡移动、等效平衡。 在相同条件下,甲、乙容器中达平衡时是等效平衡,欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,则甲中平衡向着正反应方向移动,同时乙向着逆反应方向移动或者不移动。选项A,甲、乙提高相同温度时,平衡均向逆反应方向移动,且达平衡是二者等效,HI浓度相等。选项B,加入稀有气体时,平衡不移动,二者HI浓度相等。选项C,甲降低温度平衡向着正反应方向移动,达平衡是HI浓度增大,而乙中HI浓度不变,符合题意。选项D,甲中增加等量的H2或I2,达平衡是HI浓度相等。
[解析]本题考查化学平衡移动、等效平衡。 在相同条件下,甲、乙容器中达平衡时是等效平衡,欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,则甲中平衡向着正反应方向移动,同时乙向着逆反应方向移动或者不移动。选项A,甲、乙提高相同温度时,平衡均向逆反应方向移动,且达平衡是二者等效,HI浓度相等。选项B,加入稀有气体时,平衡不移动,二者HI浓度相等。选项C,甲降低温度平衡向着正反应方向移动,达平衡是HI浓度增大,而乙中HI浓度不变,符合题意。选项D,甲中增加等量的H2或I2,达平衡是HI浓度相等。
9.(09广东化学 15)取五等份NO2 ,分别加入温度不同、容积相同的恒容密闭容器中,发生反应:
15)取五等份NO2 ,分别加入温度不同、容积相同的恒容密闭容器中,发生反应: 2NO2(g)
2NO2(g) N2O4(g),ΔH<0 反应相同时间后,分别测定体系中NO2的百分量(NO2%),并作出其随反应温度(T)变化的关系图。下列示意图中,可能与实验结果相符的是
N2O4(g),ΔH<0 反应相同时间后,分别测定体系中NO2的百分量(NO2%),并作出其随反应温度(T)变化的关系图。下列示意图中,可能与实验结果相符的是


 答案:BD
答案:BD
 解析:在恒容状态下,在五个相同的容器中同时通入等量的NO2,反应相同时间。那么则有两种可能,一是已达到平衡状态,二是还没有达到平衡状态,仍然在向正反应移动。若5个容器在反应相同时间下,均已达到平衡,因为该反应是放热反应,温度越高,平衡向逆反应方向移动,NO2的百分含量随温度升高而升高,所以B正确。若5个容器中有未达到平衡状态的,那么温度越高,反应速率越大,会出现温度高的NO2转化得快,导致NO2的百分含量少的情况,在D图中转折点为平衡状态,转折点左则为未平衡状态,右则为平衡状态,D正确。
解析:在恒容状态下,在五个相同的容器中同时通入等量的NO2,反应相同时间。那么则有两种可能,一是已达到平衡状态,二是还没有达到平衡状态,仍然在向正反应移动。若5个容器在反应相同时间下,均已达到平衡,因为该反应是放热反应,温度越高,平衡向逆反应方向移动,NO2的百分含量随温度升高而升高,所以B正确。若5个容器中有未达到平衡状态的,那么温度越高,反应速率越大,会出现温度高的NO2转化得快,导致NO2的百分含量少的情况,在D图中转折点为平衡状态,转折点左则为未平衡状态,右则为平衡状态,D正确。
8. (09广东化学
(09广东化学 7)难挥发性二硫化钽(TaS2 )可采用如下装置提纯。将不纯的TaS2 粉末装入石英管一端,抽真空后引入适量碘并封管,置于加热炉中。反应如下:
7)难挥发性二硫化钽(TaS2 )可采用如下装置提纯。将不纯的TaS2 粉末装入石英管一端,抽真空后引入适量碘并封管,置于加热炉中。反应如下:
 TaS2 (s)+2I2 (g)
TaS2 (s)+2I2 (g) TaI4 (g)+S2 (g)
TaI4 (g)+S2 (g)
 下列说法正确的是
下列说法正确的是
 A.在不同温度区域,TaI4 的量保持不变
A.在不同温度区域,TaI4 的量保持不变
 B. 在提纯过程中,I2 的量不断减少
B. 在提纯过程中,I2 的量不断减少
 C.在提纯过程中,I2 的作用是将TaS2 从高温区转移到低温区
C.在提纯过程中,I2 的作用是将TaS2 从高温区转移到低温区
 D. 该反应的平衡常数与TaI4 和S2 的浓度乘积成反比
D. 该反应的平衡常数与TaI4 和S2 的浓度乘积成反比
 答案:C
答案:C
 解析:
解析: 根据反应条件可知当温度不同时反应进行的主要方向不同所以A错误。
根据反应条件可知当温度不同时反应进行的主要方向不同所以A错误。
因为是在同一密闭系统中有质量守恒定律可知I2的量不可能不断减少,而是充当一个“搬运工”的角色,将TaS2从高温区转移到低温区,B错误。
根据平衡常数表达式可知K与Tal4 和S2 的浓度乘积成正比,D错误。
7.(09福建卷 12)某探究小组利用丙酮的溴代反应:(
12)某探究小组利用丙酮的溴代反应:( )来研究反应物浓度与反应速率的关系。反应速率
)来研究反应物浓度与反应速率的关系。反应速率 通过测定溴的颜色消失所需的时间来确定。在一定温度下,获得如下实验数据:
通过测定溴的颜色消失所需的时间来确定。在一定温度下,获得如下实验数据:


 分析实验数据所得出的结论不正确的是
分析实验数据所得出的结论不正确的是
 A. 增大
A. 增大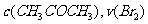 增大 B. 实验②和③的
增大 B. 实验②和③的 相等
相等
 C. 增大
C. 增大
 增大
D. 增大
增大
D. 增大 ,
, 增大
增大
答案:D
解析:从表中数据看,①④中CH3COCH3,HCl的浓度是相同的,而④中Br2比①中的大,所以结果,时间变长,即速率变慢了,D项错。其他选项依次找出表中两组相同的数据,看一变量对另一变量的影响即可。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com