
19.高炉炼铁过程中发生的主要反应

已知该反应在不同温度下的平衡常数如下:

请回答下列问题:
(1)该反应的平衡常数表达式K=_____________,△H________0(填“>”、“<”或“=”);
(2)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过l0 min后达到平衡。求该时间范围内反应的平均反应速率υ(C02)= _____________、CO的平衡转化率= _____________:
(3)欲提高(2)中CO的平衡转化率,可采取的措施是_____________。
A.减少Fe的量 B.增加Fe203的量 C.移出部分C02
D.提高反应温度
18。2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的ΔH=-99kJ·mol-1.请回答下列问题:

 (1)图中A、C分别表示 、 ,E的大小对该反应的反应热有无影响? 。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低? ,理由是 ;
(1)图中A、C分别表示 、 ,E的大小对该反应的反应热有无影响? 。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低? ,理由是 ;
(2)图中△H= KJ·mol-1;
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式 ;
(4)如果反应速率υ(SO2)为0.05 mol·L-1·min-1,则υ(O2)= mol·L-1·min-1、υ(SO3)= mol·L-1·min-1;
(5)已知单质硫的燃烧热为296 KJ·mol-1,计算由S(s)生成3 molSO3(g)的△H (要求计算过程)。
16.汽车尾气净化中的一个反应如下:
NO(g) + CO(g) 
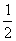 N2(g) + CO2(g);ΔH=-373.4 kJ·mol-1
N2(g) + CO2(g);ΔH=-373.4 kJ·mol-1
在恒容的密闭容器中,反应达到平衡后,改变某一条件,下列示意图正确的是:

二:非选择题(共52分)
17,废旧印刷电路板的回收利用可实现资源再生,并减少污染。废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末。
(1)用 的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
 ====
====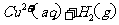

 ====
====

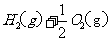 ====
====
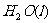
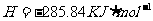
在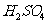 溶液中
溶液中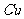 与
与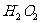 反应生成
反应生成 和
和 的热化学方程式为 。
的热化学方程式为 。
(2)控制其他条件相同,印刷电路板的金属粉末用10℅ 和3.0
和3.0 的混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
的混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
|
温度(℃) |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
铜平均溶解速率 (  ) ) |
7.34 |
8.01 |
9.25 |
7.98 |
7.24 |
6.73 |
5.76 |
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是 。
(3)在提纯后的 溶液中加入一定量的
溶液中加入一定量的 和
和 溶液,加热,生成
溶液,加热,生成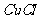 沉淀。制备
沉淀。制备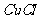 的离子方程式是
。
的离子方程式是
。
14.各可逆反应达平衡后,改变反应条件,其变化趋势正确的是

15某探究小组利用丙酮的溴代反应( )来研究反应物浓度与反应速率的关系。反应速率
)来研究反应物浓度与反应速率的关系。反应速率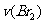 通过测定溴的颜色消失所需的时间来确定。在一定温度下,获得如下实验数据:
通过测定溴的颜色消失所需的时间来确定。在一定温度下,获得如下实验数据:

分析实验数据所得出的结论不正确的是
A.增大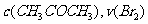 增大 B.实验②和③的
增大 B.实验②和③的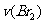 相等
相等
C.增大
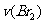 增大
D.增大
增大
D.增大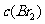 ,
,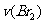 增大
增大
13.在一体积可变的密闭容器中,加入一定量的X、Y,发生反应mX(g) nY(g);ΔH=Q
kJ/mol。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示:
nY(g);ΔH=Q
kJ/mol。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示:
|
|
1 |
2 |
4 |
|
100 |
1.00 |
0.75 |
0.53 |
|
200 |
1.20 |
0.90 |
0.63 |
|
300 |
1.30 |
1.00 |
0.70 |
下列说法正确的是
A.m>n
B.Q<0
C.温度不变,压强增大,Y的质量分数减少
D.体积不变,温度升高,平衡向逆反应方向移动
11.反应A+3B=4C+2D,在不同条件下反应,其平均反应速率v(X)(表示反应物的消耗速率或生成物的生成速率)如下,其中反应速率最快的是 ( ) A.v(A)=0.4mol/(Ls) B.v(B)=0.8mol/(Ls) C.v(C)=1.2mol/(Ls) D.v(D)=0.7mol/(Ls)
12在容积一定的密闭容器中,可逆反应:

A2(g)+
B2(g) x C(g)符合下列图Ⅰ所示关系。由此推断,对图Ⅱ的说法正确的是
x C(g)符合下列图Ⅰ所示关系。由此推断,对图Ⅱ的说法正确的是
A.P3>P4,Y轴表示混合气体的平均摩尔质量
B.P3<P4,Y轴表示A2的浓度
C.P3>P4,Y轴表示混合气体的密度
E P3<P4,Y轴表示A2的转化率
10.某温度下,  的平衡常数
的平衡常数 .该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如右表所示。下列判断不正确的是
.该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如右表所示。下列判断不正确的是

A.平衡时,乙中CO2的转化率大于60%
B.平衡时,甲中和丙中H2的转化率均是60%
C.平衡时,丙中c(CO2)是甲中的2倍,是0.012mol/L
D.反应开始时,丙中的反应速率最快,甲中的反应速率最慢
7. 已知2H2(g)+ O2(g)=2H2O(l) ΔH= -571.6KJ· mol-1
CH4(g)+ 2O2(g)=CO2(g)+2H2O(l) ΔH= -890KJ· mol-1
现有H2与CH4的混合气体112L(标准状况),使其完全燃烧生成CO2和H2O(l),若实验测得反应放热3695KJ,则原混合气体中H2与CH4的物质的量之比是
A.1∶1 B.1∶3
C.1∶4 D.2∶3
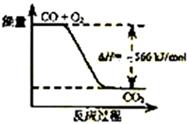 8.已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ/mol
8.已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ/mol
Na2O2(s)+CO2(g)=Na2CO3(s)+
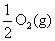 ΔH=-226 kJ/mol
ΔH=-226 kJ/mol
根据以上热化学方程式判断,下列说法正确的是
A.CO的燃烧热为283 kJ
B.右图可表示由CO生成CO2的反应过程和能量关系
C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ΔH>-452 kJ/mol
D.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
D.2C8H18(g)+25O (g)=16CO
(g)=16CO (g)+18H
(g)+18H O(1);
O(1);
 H=
H= 5518
kJ/mol
5518
kJ/mol
9.下列热化学方程式数学正确的是( 的绝对值均正确)
的绝对值均正确)
A.C2H5OH(l)+3O2(g)==2CO2(g)+3H2O(g);△H=-1367.0 kJ/mol(燃烧热)
B.NaOH(aq)+HCl(aq)==NaCl(aq)+H2O(l);△H=+57.3kJ/mol(中和热)
C.S(s)+O2(g)===SO2(g);△H=-269.8kJ/mol(反应热)
D.2NO2==O2+2NO;△H=+116.2kJ/mol(反应热)
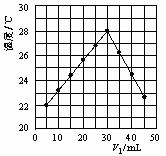
6.将V1 mL 1.0 mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50 mL)。下列叙述正确的是( )
A.做该实验时环境温度为22 ℃
B.该实验表明化学能可以转化为热能
C.NaOH溶液的浓度约是1.00 mol/L
D.实验表明有水生成的反应都是放热反应
5.下列说法正确的是
A.需要加热的化学反应都是吸热反应
B.中和反应都是放热反应
 C.原电池是将电能转化为化学能的一种装置
C.原电池是将电能转化为化学能的一种装置
D.水力发电是将化学能转化为电能的过程
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com