
4. A.B均为原子序数1-20的元素,已知A的原子序数为n,A2+离子比B2-离子少8个电子,则B的原子序数是 ( )
A.n+4 B.n+6 C.n+8 D.n+10
3.下列各组元素中,按最高正价递增顺序排列的是 ( )
A.C.N、O、F B.K、Mg、C.S
C.F、Cl、Br、I D.Li、Na.K、Rb
2.下列化合物中,阳离子与阴离子半径比最小的是( )
A NaF B LiI C CsF D LiF
1、下列元素的原子半径依次减小的是( AB )
A. Na、Mg、Al B. N、O、F
C. P、Si、Al D. C、Si、P
7、比较O2― 与F― 半径大小
[随堂练习]写出下列微粒的半径由大到小的顺序:F― 、O2― 、Na+ 、Mg2+
[过]从以上的学习我们可以知道,随着元素原子序数的递增,元素的原子结构呈现周期性的变化。那么,元素的性质是否也会有周期性的变化呢?我们从元素的化合价(一种元素的原子在和其他元素一定数目的原子化合时所表现出来的性质)和金属性和非金属性两个方面来进行探讨。
[投影]
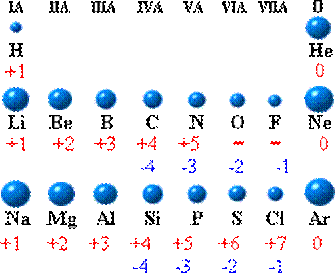

[问]请大家参考1-18号元素的原子结构示意图,结合上表同内容,能够发现哪些有关元素化合价知识的规律?
[投影小结]
(1) 最高正价与最外层电子数相等
(2) 最外层电子数≧4时出现负价
(3) 最高正化合价与负化合价绝对值和为8
(4) 金属元素无负价
(5) 氟无正价
[讲]大家总结很详细,要熟记这些知识,对于稀有气体元素,由于他们的化学性质不活泼,在通常状况下难与其他物质发生化学反应。因此,把它们的化合价看作是0。
[投影小结]元素主要化合价变化规律性
|
原子序数 |
主要化合价的变化 |
|
1-2 |
+1 0 0 |
|
3-10 |
+1 +5 +5-4  -1 -1 0 0 |
|
11-18 |
+1 +7 +7-4  -1 -1 0 0 |
[板书]3、随着原子序数的递增,元素化合价呈现周期性变化
[过]元素的化学性质是由元素的原子结构决定的,原子结构决定了原子在参加化学反应时得失电子的难易程度。请大家根据己学知识分析3-9、11-17号元素,随原子序数的递增得失电子的难易程度
3-9、11-17号元素随原子序数的递增,原子半径逐渐变小,得电子能力逐渐增强,失电子能力逐渐减弱,
[讲]我们知道,原子得失电子能力的强弱决定了元素金属性与非金属性强弱。
[板书]4、随着原子序数的递增,元素金属性与非金属性呈现周期性变化
[讲]纵观以上结论,我们可归纳出这样一条规律:
[板书]元素的性质随元素原子序数的递增呈现周期性变化,这个规律叫元素周期律。
元素周期律的实质: 元素性质的周期性变化是元素原子的核外电子排布的周期性变化的必然结果。
[总结]由于元素的性质是由组成该元素的原子结构决定的,元素的核外电子排布的周期性变化,决定了元素性质的周期性变化,这也是元素周期律的实质。
[自我评价]
6、比较Na+与Mg2+半径大小
5、比较Fe、Fe2+与Fe3+的半径大小
4、比较Cl― 与Cl的半径大小
3、比较Na与Na+的半径大小
2、比较Na原子与Li原子的原子半径大小
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com