
2. 下图X、Y、Z是细胞中的三种化合物,X为细胞的主要能源物质,Y、Z是构成细胞膜的主要成分。下列有关说法正确的是( )
下图X、Y、Z是细胞中的三种化合物,X为细胞的主要能源物质,Y、Z是构成细胞膜的主要成分。下列有关说法正确的是( )
A.细胞膜会被蛋白酶分解,说明组成细胞膜
的物质中有Z
B.细胞的识别与细胞膜上Y和X的结合物
有关
C.维生素D可优先通过细胞膜扩散到细胞内
部与Y有关
 D.构成细胞膜的Y、Z都可以运动,说明细胞膜具有选择透过性
D.构成细胞膜的Y、Z都可以运动,说明细胞膜具有选择透过性
1.元素和化合物是细胞的物质基础,下列相关叙述正确的是( )
A.具有生物催化作用的酶都是由氨基酸组成的
B.ATP和染色体中含有的五碳糖都是核糖
C.一条由n个氨基酸组成的肽链中含有的氧原子数目至少为n+1个
D.由核糖体合成,经高尔基体加工成的具有生物活性的固氮酶,能将N2还原成NH3
①不能与H+共存的离子有 、
②不能与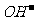 共存的离子有
、
共存的离子有
、
③不能与 共存的离子有
、
共存的离子有
、
④不能与Al3+共存的离子有 、
⑤不能与 共存的离子有
、
共存的离子有
、
⑥不能与Fe3+共存的离子有 、
⑦不能与Fe2+共存的离子有 、
⑧不能与 共存的离子有
、
共存的离子有
、
试题枚举
[例1] (2006江苏,13)下列叙述正确的是
A.0.1mol·L-1氨水中,c(OH-)==c(NH4+)
B.10 mL 0.02mol·L-1HCl溶液与10 mL 0.02mol·L-1Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=12
C.在0.1mol·L-1CH3COONa溶液中,c(OH-)==c(CH3COOH)+c(H+)
D.0.1mol·L-1某二元弱酸强碱盐NaHA溶液中,c(Na+)==2c(A2-)+c(HA-)+c(H2A)
解析:NH3·H2O是弱电解质,它本身电离所产生的两种离子浓度相等,得氨水中的部分OH-来自于H2O的电离,所以c(OH-)>c(NH4+),A错;B项中酸碱中和反应后,
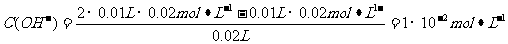
pH=-lgC(H+)=-lg(10-14/10-12)=12,B正确;根据盐的消解规律,可以判断C正确;D项中因钠元素的离子与A原子的物质的量之比为1∶1,对应关系应该为c(Na+)=c(A2-)+c(HA-)+c(H2A),D错。
答案:BC
[例2] (2006四川,12)25℃时,将稀氨水逐滴加入到稀硫酸中,当溶液的PH=7时,下列关系正确的是
A.c(NH4+)==c( )
B.c(NH4+)>c(SO42-)
)
B.c(NH4+)>c(SO42-)
C.c(NH4+)<c( ) D.c(OH-)+c(
) D.c(OH-)+c( )==c(H+)+c(NH4+)
)==c(H+)+c(NH4+)
解析: 氨水与稀硫酸反应,至溶液呈中性,即c(H+)=c(OH-);根据电荷守恒有:c(NH4+)+c(H+)=c(OH-)+2c( ),则D错;将前两个等式融合得, c(NH4+)=2c(
),则D错;将前两个等式融合得, c(NH4+)=2c( ),则A错,B对,C错。
),则A错,B对,C错。
答案: B
[例3] 已知0.1 mol·L-1的二元酸H2A溶液的pH=4.0,则下列说法正确的是( )
A.在Na2A、NaHA两溶液中,离子种类不相同
B.在溶质物质的量相等的Na2A、NaHA两溶液中,阴离子总数相等
C.在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(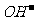 )+2c(A2-)
)+2c(A2-)
D.在Na2A溶液中一定有:c(Na+)>c(A2-)>c(H+)>c(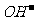 )
)
解析:0.1 mol·L-1的强酸pH=1.0,0.1
mol·L-1的H2A溶液pH=4.0,说明它是一种弱酸。Na2A发生水解A2-+H2O HA-+OH-和HA-+H2O
HA-+OH-和HA-+H2O H2A+OH-,溶液中存在HA-、A2-、H+、OH-;NaHA发生水解HA-+H2O
H2A+OH-,溶液中存在HA-、A2-、H+、OH-;NaHA发生水解HA-+H2O H2A+OH-和电离HA-
H2A+OH-和电离HA- H++A2-,溶液中存在HA-、A2-、H+、OH-,所以两溶液中离子种类相同,A不正确。
H++A2-,溶液中存在HA-、A2-、H+、OH-,所以两溶液中离子种类相同,A不正确。
物质的量相等的Na2A和NaHA因为存在上述水解、电离等过程,阴离子数量发生变化,所以阴离子总量不相等,B不正确。
由电荷守恒可知c(Na+)+c(H+)=c(HA-)+c(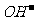 )+2c(A2-),C正确。Na2A溶液显碱性,c(
)+2c(A2-),C正确。Na2A溶液显碱性,c(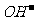 )>c(H+),D不正确。
)>c(H+),D不正确。
答案: C
[例4] 化合物SOCl2是一种液态化合物,沸点77 ℃。在盛有10 mL水的锥形瓶中,小心地滴加8-10滴SOCl2,可观察到剧烈反应,液面上有白雾形成,并有带刺激性气味的气体逸出。该气体可使滴有品红试液的滤纸褪色。轻轻振荡锥形瓶,等白雾消失后,往溶液中滴加AgNO3溶液,有不溶于HNO3的白色凝乳状沉淀析出。
(1)根据上述实验,写出SOCl2和水反应的化学方程式:________________。
(2)AlCl3溶液蒸干灼烧得不到无水AlCl3,而用SOCl2与AlCl3·6H2O混合共热,可得到无水AlCl3,原因是________________。
解析:水解的本质是化合物中带正电的基团结合水中电离产生的OH-,而带负电部分结合水中电离产生的H+。据题给信息分析,产生的刺激性气体应是SO2,它是由SO2+结合OH-转化成H2SO3,而另一带负电的Cl-结合水电离的H+生成HCl,与AgNO3反应生成白色的AgCl沉淀。
答案: (1)SOCl2+H2O====SO2↑+2HCl
(2)因为蒸干AlCl3溶液时,由于AlCl3水解生成的HCl易挥发,而得到Al(OH)3,但当与SOCl2混合共热时,由于SOCl2极易吸水,防止了AlCl3的水解,有关的化学方程式为6SOCl2+AlCl3·6H2O====6SO2↑+AlCl3+12HCl
[例5]用酚酞、石蕊、0.1mol/L氨水、氯化铵晶体、0.1mol/L盐酸、熟石灰和蒸馏水,若仅用上述试剂怎样用简单实验方法证明氨水是弱碱?并指出是通过什么途径证明氨水是弱碱的?
解析:证明氨水是弱碱,可通过两条途径:一是证明氨水中存在电离平衡,如方案(1)。另一是证明NH4+作为弱碱阳离子能破坏水的电离平衡发生水解反应,如方案(2)、(3)。
答案: 方案(1)取少量氨水,滴加酚酞,溶液呈红色,然后向其中加人少量CH3COONH4晶体,振荡,可看到红色变浅,说明氨水中存在电离平衡,氨水为弱碱。
方案(2)取少量NH4Cl晶体溶于水,滴加石蕊试液,溶液显红色,说明NH4+水解生成了NH3·H2O和HCl,从而破坏了水的电离平衡,亦说明氨水是弱碱。
方案(3)将 0.1mol/L NH3· H2O与0.1mol/L盐酸等体积混合,再滴加石蕊试剂,溶液显红色,说明NH4+水解破坏了水的电离平衡,从而说明氨水是弱碱。
[变式]解释说明化学事实:向盛有少量Mg(OH)2 悬浊液培养皿中加入适量的饱和氯化铵溶液。现象
讨论解释其原因:同学甲:实验中存在Mg(OH)2的溶解、结晶平衡: Mg(OH)2(固)
 Mg2++2OH-。当加入NH4Cl时,由于NH4+水解,NH4++H2O
Mg2++2OH-。当加入NH4Cl时,由于NH4+水解,NH4++H2O NH3·H2O+H+,使溶液呈酸性。H++OH-=H2O,从而使溶液中[OH-]减小,促进Mg(OH)2溶解,使溶液澄清。同学乙:实验中加入NH4Cl后,溶液中NH4+可与OH-结合从而使Mg(OH)2的溶解平衡右移使溶液澄清。甲、乙同学的两种解释谁的更有道理?
通过实验来进一步验证:
。为什么乙更合理?
NH3·H2O+H+,使溶液呈酸性。H++OH-=H2O,从而使溶液中[OH-]减小,促进Mg(OH)2溶解,使溶液澄清。同学乙:实验中加入NH4Cl后,溶液中NH4+可与OH-结合从而使Mg(OH)2的溶解平衡右移使溶液澄清。甲、乙同学的两种解释谁的更有道理?
通过实验来进一步验证:
。为什么乙更合理?
答案: Mg(OH)2溶解,使溶液澄清;乙同学的解释合理;向盛有少量Mg(OH)2悬浊液的培养皿中加入CH3COONH4 固体,观察悬浊液是否变澄清。CH3COONH4属弱酸弱碱盐,虽强烈水解但溶液呈中性。同时,CH3COONH4溶液中也有大量NH4+,若Mg(OH)2没有溶解,说明甲同学的解释正确。若Mg(OH)2溶解,则说明乙同学的解释正确;因为Mg(OH)2比 NH3· H2O的碱性强。
21世纪教育网
Ⅰ.判断溶液的酸碱性: ;
Ⅱ.判断不同弱电解质的相对强弱: ;
Ⅲ.比较溶液中离子浓度:
①同一溶液中不同离子浓度: 、
②不同溶液中相同离子浓度: 。
Ⅳ.解释某些化学现象及在生产生活中的应用: 。
。
⑴电荷守恒:电解质溶液中阴、阳离子所带的正、负电荷数相等,即溶液不显电性。如磷酸溶液中,c (H+)= c (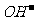 )+ c(
)+ c( )+2 c(
)+2 c( -)+3 c(
-)+3 c( )
)
⑵物料守恒:就是电解质溶液中某一组分的原始浓度(起始浓度)应该等于它在溶液中各种存在形式的浓度之和。如0.1mol/L的NaHS溶液,0.1= c (HS-)+ c (S2-)+ c (H2S)或
c (Na+)= c (HS-)+ c (S2-)+ c (H2S)
⑶原理守恒:水电离的特征是c (H+)= c (OH-),据此可以得出下列关系如在K2CO3溶液中:c (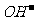 )= c (H+)+ c (
)= c (H+)+ c ( )+2(H2CO3)(也称质子守恒)
)+2(H2CO3)(也称质子守恒)
例题:分别以①H2S②NaHS③Na2S为例离子浓度的守恒关系:
⑴物料守恒① 、
② ③
⑵电荷守恒:① ②
③ ;
⑶质子守恒:① ②
③ 。
①多元弱酸溶液,根据多步电离分析,如在H3PO4的溶液中,c (H+)>c( )>c(
)>c( )>c(
)>c( )
)
②多元弱酸的正盐溶液根据弱酸根的分步水解分析,如Na2CO3的溶液中,c (Na+)>c(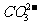 )>c(
)>c(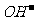 )>c(
)>c( )
)
③不同溶液中同一离子浓度的比较,要看溶液中其他离子对其影响的因素。如在相同的物质的量浓度的下列各溶液中a、NH4Cl b、CH3COONH4 c、NH4HSO4。c(NH4+)由大到小的顺序是 c>a>b。
④ 混合溶液中各离子浓度的比较,要进行综合分析,如电解因素、水解因素等。
分别以H2S、NaHS、Na2S为例:
①离子浓度的大小比较:H2S 、NaHS 、Na2S 。
①强酸弱碱盐的水解:溶液呈酸性,弱碱阳离子水解
②强碱弱酸盐的水解:溶液呈碱性,弱酸根离子水解
③弱酸弱碱盐的水解程度很大,溶液的酸碱性决定与酸碱性的相对强弱
Ⅰ.酸强于碱显酸性,如(NH4)2SO3
Ⅱ.碱强于酸显碱性,如NH4CN
Ⅲ.酸碱强弱相当的呈中性,如CH3COONH4
④强酸强碱盐,不水解,呈中性
⑤弱酸的酸式盐水解,酸取决于酸根离子的电离程度和水解程度的相对大小
Ⅰ如电离程度大于水解程度,以电离为主,溶液呈酸性,如NaHSO3、NaH2PO4
Ⅱ如水解程度大于电离程度,以水解为主,溶液呈碱性,如NaHCO3、Na2HPO4、NaHS
⑥完全双水解的盐,如Al3+与HCO3-、CO32-、S2-、AlO2-等发生双水解进行到底。
①多元弱酸根离子水解,以第一步为主;
②多元弱碱阳离子可书写一步总反应方程式;
③水解程度一般很小,故方程式用“ ”符号,且产生的物质的浓度太小,一般不用“↑”、“↓”表示;
”符号,且产生的物质的浓度太小,一般不用“↑”、“↓”表示;
④双水解比单水解程度大,有些可以进行到底。
⑴概念: 。
⑵实质: 。
⑶盐类水解的规律 。
如果要判断盐类是否发生水解反应或水解后溶液的酸碱性,要看盐的离子对应的酸或碱的相对强弱。
①在通常情况下,盐类水解的程度是很小的,并且反应前后均有弱电解质存在,因而盐的水解反应是可逆的。
②有弱才水解,谁弱谁水解,谁强显谁性,越弱越水解,都弱都水解,两强不水解。
③盐对应的酸(或碱)越弱,水解程度越大,溶液的碱性(或酸性)越强。
④多元弱酸根离子,正酸根离子比酸式酸根离子水解程度大很多。
⑷影响盐类水解的因素:决定因素是盐的结构和性质。
①温度:盐类水解是吸热,升温,水解程度增大。
②浓度:水解过程是一个微粒总量(不考虑水分子)增加的过程,因而加水稀释,平衡向右移动,水解程度加大,而水解产生的H+(或OH-)的浓度减小。
③加入酸、碱等物质:水解显酸性的盐溶液中加入碱,肯定促进盐的水解,加入酸,抑制盐的水解;水解显碱性的同理。总之水解平衡遵从化学平衡移动原理。
6.在半径为 的圆中,圆心角为周角的
的圆中,圆心角为周角的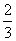 的角所对圆弧的长为
.
的角所对圆弧的长为
.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com