
4.两点的球面距离:
球面上两点之间的最短距离,就是经过两点的大圆在这两点间的一段劣弧的长度,我们把这个弧长叫做两点的球面距离
3.经度、纬度:
经线:球面上从北极到南极的半个大圆;
纬线:与赤道平面平行的平面截球面所得的小圆;
经度:某地的经度就是经过这点的经线与地轴确定的半平面与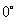 经线及轴确定的半平面所成的二面角的度数;
经线及轴确定的半平面所成的二面角的度数;
纬度:某地的纬度就是指过这点的球半径与赤道平面所成角的度数

 1
1  球的概念:
球的概念:
与定点距离等于或小于定长的点的集合,叫做球体,简称球 定点叫球心,定长叫球的半径
定点叫球心,定长叫球的半径 与定点距离等于定长的点的集合叫做球面
与定点距离等于定长的点的集合叫做球面 一个球或球面用表示它的球心的字母表示,例如球
一个球或球面用表示它的球心的字母表示,例如球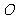 .
.
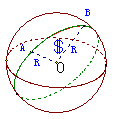
2.球的截面:
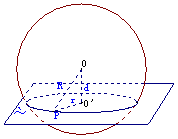 用一平面
用一平面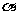 去截一个球
去截一个球 ,设
,设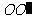 是平面
是平面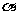 的垂线段,
的垂线段, 为垂足,且
为垂足,且 ,所得的截面是以球心在截面内的射影为圆心,以
,所得的截面是以球心在截面内的射影为圆心,以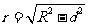 为半径的一个圆,截面是一个圆面
为半径的一个圆,截面是一个圆面
球面被经过球心的平面截得的圆叫做大圆,被不经过球心的平面截得的圆叫做小圆
22、将10gCu粉置于20ml硝酸中,微热,反应过程中,随着硝酸浓度降低,生成的气体颜色由红棕色变浅,共收集到2.016L标况体气(气体由NO、NO2和N2O4组成,其中有0.224L的N2O4),溶液中还残有2.96g固体。
(1)求反应中被还原的硝酸和未被还原的硝酸的物质的量之比(2分)
(2)求该硝酸的物质的量浓度(2分)
(3)求混合气体中NO、NO2的物质的量之比(3分)
江西省莲塘一中2011届高三第一次统考
21.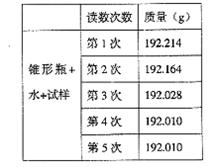 某种含有少量氧化钠的过氧化钠试样(已知试样质量为1.560g、锥形瓶和水的质量为190.720g),利用左图装置测定混合物中Na2O2的质量分数,每隔相同时间读得电子天平的数据如表:
某种含有少量氧化钠的过氧化钠试样(已知试样质量为1.560g、锥形瓶和水的质量为190.720g),利用左图装置测定混合物中Na2O2的质量分数,每隔相同时间读得电子天平的数据如表:
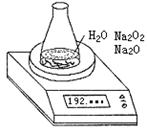
(1)(3分)写出Na2O2和H2O反应的化学方程式
(2)(3分)计算过氧化钠质量分数时,必需的数据是
不必作第6次读数的原因是
(3)(4分)测定上述样品(1.560g)中Na2O2质量分数的另一种方案,其操作流程如下:
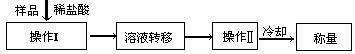
①操作Ⅱ的名称是 ②需直接测定的物理量是
③测定过程中需要的仪器有电子天平、蒸发皿、酒精灯,还需要 、 (固定、夹持仪器除外)
④在转移溶液时,如溶液转移不完全,则Na2O2质量分数的测定结果 (填偏大、偏小或不变)。
20、(8分)少量碘化物的含量可用以下方法进行测定,其步骤如下: ①在中性或弱酸性介质中先用过量的Br2将样品中的I-氧化成IO3-; ②煮沸①所得溶液以除去过量的Br2,然后在酸性条件下加入过量的KI溶液,将IO3- 还原为I2;③在②中加淀粉作指示剂,用Na2S2O3标准溶液滴定(2Na2S2O3+I2=2NaI+Na2S4O6)。 通过上述步骤可测得碘化物中I-的含量。 (1)写出步骤①②中发生反应的离子方程式。
① ② (2)若样品中有1mol I-,则最后耗用Na2S2O3的物质的量是 (3)若在测定时,准确量取含KI的样品溶液25.00mL,终点时耗用0.100mol/LNa2S2O3溶液20.06mL,则样品溶液中KI的含量(g/L)。
19、(10分,每空2分)下表是某食用碘盐包装袋上的部分说明:
|
配 料 |
食盐、碘酸钾、抗结剂 |
|
碘含量 |
35±15mg/kg |
|
储藏方法 |
密封、避光、防潮 |
|
食用方法 |
烹饪时,待食品熟后加入碘盐 |
(1)下列说法正确的是
A.高温会导致碘的损失 B.碘酸钾可氧化氯化钠
C.只用淀粉就能检验碘盐中的碘酸钾 D.该碘盐中碘酸钾含量为20~50mg/kg
(2)碘酸钾在工业上可用电解法制取。以石墨和不锈钢为电极,以KI溶液为电解液,在一定条件下电解,反应的方程式为KI + 3H2O KIO3 + 3H2↑。则阳极电极反应式为
(3)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式,并标出电子转移的方向
和数目。
KIO3+ KI+ H2SO4= K2SO4+ I2+ H2O该反应的氧化剂为
(4)已知:I2+2S2O32-=2I-+S4O62-。某学生测定食用碘盐中碘的含量,其步骤为:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol·L-1的Na2S2O3溶液10.0mL,恰好反应完全。则所测盐中碘的含量是(以含w的代数式表示) mg/kg。
18、(12分,每空2分)某强碱性溶液中可能含有的离子是K+、NH4+、Al3+、AlO2-、
SO42-、SiO32-、CO32-、Cl-中的某几种离子,现进行如下实验:
①取少量的溶液用硝酸酸化后,加Ba(NO3)2溶液,无沉淀生成。
②另取少量溶液逐滴加入盐酸,其现象是:一段时间保持原样后,开始产生沉淀并逐渐增多,沉淀量基本不变后产生一种气体,最后沉淀逐渐减少至消失。
(1)原溶液中肯定存在的离子是_____________,肯定不存在的离子是_______________。
(2)已知一定量的原溶液中加入5mL 0.2mol/L盐酸时,沉淀会完全消失,加入足量的硝酸银溶液可得到沉淀0.18655g,则原溶液中是否含有Cl-?_________________。
(3)按照反应顺序逐步书写出②中发生反应的离子反应方程式
a:H++OH-=H2O b:__________________
c:__________________ d:HCO3-+H+=H2O+CO2↑ e:
17.(5分,每小题1分)按要求书写下列反应的离子方程式
(1)向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至中性
(2)Ca(OH)2溶液与足量NaHCO3溶液反应
(3)足量Ca(OH)2溶液与NaHCO3溶液反应
(4)硝酸银和足量的氨水反应
(5)氯气和少量的溴化亚铁反应
16.请根据反应15CuSO4+11P+24H2O==5Cu3P +6H3PO4+15H2SO4,则被1 mol CuSO4所氧化P的物质的量 ( )
A. 0.4 mol B. 0.5 mol C.0.2 mol D. 0.3 mol
第Ⅱ卷
二:填空题
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com