
24.(2010·启东模拟)W、X、Y、Z是原子序数依次增大的同一短同期元素,W、X是金属元素,Y、Z是非金属元素。
(1)W、X各自的最高价氧化物对应的水化物可以反应生盐和水,该反应的离子方程式为______________________________________________________。
(2)W与Y可形成化合物W2Y,该化合物的电子式为_________。
(3)X的硝酸盐水溶液显______性,用离子方程式解释原因__________________。
(4)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为_________。
(5)比较Y、Z气态氢化物的稳定性:_________>_________(用分子式表示)。
(6)W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是:
_________>_________>_________>_________。
(7)Z的最高价氧化物为无色液体,0.25mol该物质与一定量水混合得到一种稀溶液,并放出QkJ的热量。写出该反应的热化学方程式__________________。
[解析](1)W、X为金属,其最高价氧化物对应的水化物为碱,且两种碱可以反应生成盐和水,则为NaOH和Al(OH)3,二者反应的离子方程式:Al(OH)3+OH-=
AlO2-+2H2O。
(2)W为Na,W可以和Y形成W2Y,则Y为-2价,为ⅥA元素,且和钠同周期,所以为S。W2Y为Na2S,电子式为: 。
。
(3)Y的硝酸盐为Al(NO3)3,由于Al3+的水解:Al3++3H2O Al(OH)3+3H+,其溶液呈酸性。
Al(OH)3+3H+,其溶液呈酸性。
(4)Y的低价氧化物为SO2;并且Z和Y同周期,原子序数比Y大,所以Y为Cl。Y的低价氧化物和Z的单质反应的方程式:SO2+Cl2+2H2O=H2SO4+2HCl。
(5)非金属性越强,气态氢化物的稳定性越强;由于非金属性:Cl>S,所以气态氢化物的稳定性:HCl>H2S。
(6)对电子层结构相同的单核离子,核电荷数越大,则离子半径越小,10电子离子半径比较关系有:r(N3-)>r(O2-)>r(F-)>r(Na+)>r(Mg2+)>r(Al3+);18电子离子半径比较关系有:r(S2-)>r(Cl-)>r(K+)>r(Ca2+);同族离子电子层数越多,离子半径越大,r(Cl-)>r(F-),综合上述关系得出:r(S2-)>r(Cl-)>r(Na+)>r(Al3+)。
(7)Z的最高价氧化物为Cl2O7是酸性氧化物,与水反应生成对应的酸:Cl2O7+H2O=2HClO4,0.25mol Cl2O7放出QkJ的热量,故△H<0,对应的热化学方程式为:Cl2O7(l)+H2O(l)=2HClO4(aq) △H=-4QkJ/mol。
[答案](1)Al(OH)3+OH-=AlO2-+2H2O (2) 。
。
(3)酸;Al3++3H2O Al(OH)3+3H+ ;(4)SO2+Cl2+2H2O=H2SO4+2HCl ;(5)HCl>H2S
Al(OH)3+3H+ ;(4)SO2+Cl2+2H2O=H2SO4+2HCl ;(5)HCl>H2S
(6)r(S2-)>r(Cl-)>r(Na+)>r(Al3+)
(7)Cl2O7(l)+H2O(l)=2HClO4(aq);△H=-4QkJ/mol。
23.(2010·苏州模拟)下表给出了五种元素的相关信息,其中A、B、C、D为短周期元素。
|
元素 |
相关信息 |
|
A |
在常温、常压下,其单质是气体,随着人类对环境的认识和要求的提高,它将成为倍受青睐的清洁燃料。 |
|
B |
工业上通过分离液态空气获得其单质,其某种同素异形体是保护地球地表环境的重要屏障。 |
|
C |
植物生长三要素之一,它能形成多种氧化物,其中一种是早期医疗中使用的麻醉剂。 |
|
D |
室温下其单质呈粉末状固体,加热易熔化。该单质在氧气中燃烧,发出明亮的蓝紫色火焰。 |
|
E |
它是人体不可缺少的微量元素,其单质也是工业生产中不可缺少的金属原材料,常用于制造桥梁、轨道等。 |
根据上述信息填空:
(1)B在元素周期表中的位置是__________,画出D的原子结构示意图__________。
(2)D的单质与烧碱水溶液加热时自身的氧化还原反应生成两种具有强还原性的阴离子,写出该反应的离子方程式____________________。
(3)C与A形成的某一化合物能和C与B形成的另一无色化合物(这两种化合物分子中原子个数比皆为1∶2)一起用作火箭助推剂,写出两者发生反应生成无毒物质的化学方程式________________________________________。
(4)某矿藏主要含D、E两种元素组成的化合物,它是我国生产某强酸的主要原料。试写出该生产过程中第一阶段主要反应的化学方程式_________________________。
(5)以上这五种元素能组成一种工业上用途极广的复盐(含一种阴离子和多种阳离子),该物质中的A、B、C、D、E的质量比为5∶56∶7∶16∶14。请写出该化合物的化学式__________________。其水溶液的pH_____7(填“>”、“=”或“<”)。
[解析]氢气是一种清洁燃料,所以A为氢元素;臭氧对紫外线有吸收作用,是保护地球地表环境的重要屏障,所以B为氧元素;氮磷钾是植物生长三要素,N2O俗名“笑气”,是早期医疗中使用的麻醉剂,所以C为氮元素;单质硫在氧气中燃烧,发出明亮的蓝紫色火焰,所以D为硫元素;日常生产和生活中最常用的金属是铁、铜和铝,其中只有铁是人体不可缺少的微量元素,所以E为铁元素。(2)能够在碱性溶液中存在的含硫的阴离子有S2-、SO32-和SO42-,前二者具有强还原性,所以单质硫与烧碱溶液加热时生成Na2S和Na2SO3。(3)氮和氢形成的原子个数比为1∶2的化合物为N2H4,氮和氧形成的原子个数比为1∶2的化合物有NO2和N2O4,其中N2O4是无色气体,NO2是红棕色气体,N2H4和N2O4反应生成的无毒的N2和H2O。(4)我国主要以黄铁矿(主要成分是FeS2)为原料制备硫酸,其第一阶段主要反应是煅烧黄铁矿。(5)n(H)∶n(O)∶
n(N)∶n(S)∶n(Fe)=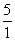 ∶
∶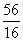 ∶
∶ ∶
∶ ∶
∶ =20∶14∶2∶2∶1,其两种阳离子只可能是2个NH4+和1个Fe2+或Fe3+,阴离子只能是2个SO42-,根据电荷守恒判断阳离子只可能是Fe2+,根据质量守恒定律判断剩余12个氢原子应该以6个水的形式存在,所以其化学式为:(NH4)2Fe(SO4)2·6H2O,NH4+和1个Fe2+水解都显酸性,所以其溶液的pH<7。
=20∶14∶2∶2∶1,其两种阳离子只可能是2个NH4+和1个Fe2+或Fe3+,阴离子只能是2个SO42-,根据电荷守恒判断阳离子只可能是Fe2+,根据质量守恒定律判断剩余12个氢原子应该以6个水的形式存在,所以其化学式为:(NH4)2Fe(SO4)2·6H2O,NH4+和1个Fe2+水解都显酸性,所以其溶液的pH<7。
 [答案](1)第二周期第VIA族
[答案](1)第二周期第VIA族
(2)3S+6OH- SO32-+2S2-+3H2O
SO32-+2S2-+3H2O
(3)N2H4+N2O4 3N2+4H2O
3N2+4H2O
(4)4FeS2+11O2 2Fe2O3+8SO2
2Fe2O3+8SO2
(5)(NH4)2Fe(SO4)2·6H2O <
22.(2010·南通模拟)W、X、Y、Z是原子序数依次增大的同一短周期元素,W是金属元素,X是地壳中含量最多的金属元素,且W、X的最高价氧化物的水化物相互反应生成盐和水;Y、Z是非金属元素,Y与W可形成离子化合物W2Y;G在Y的前一周期,其原子最外层比Y原子最外层少1个电子。
(1)X的原子结构示意图为_____________________。
(2)W、X的最高价氧化物的水化物相互反应的离子方程式为______________。
(3)工业上制取X单质的化学方程式为____________________________。
(4)G的气态氢化物与Y的最高价氧化物的水化物恰好反应生成的正盐溶液中,离子浓度由大到小的顺序为___________________________________。在催化剂作用下,汽车尾气中G的氧化物GO与一氧化碳两种气体能相互反应转化为无污染、能参与大气循环的两种气体,若有33.6L(已换算成标准状况)一氧化碳参加反应,转移的电子数为_______mol。
(5)298K时,Z的最高价氧化物为无色液体,0.25mol该物质与一定量水混合得到Z的最高价氧化物的水化物的稀溶液,并放出akJ的热量。该反应的热化学方程式为________________________________________________________。
(6)实验室制备Y的单质时,常用排WY的饱和溶液法进行收集,其理由是(请结合化学平衡理论简要分析说明)______________________________________。
[解析]地壳中含量最多的金属元素是Al,W的最高价氧化物的水化物能够和
Al(OH)3反应生成盐和水,所以W为Na元素,Y与W可形成离子化合物W2Y,说明Y显-2价,所以Y为S元素,其最外层有6个电子,G最外层有5个电子,为N元素。Z的原子序数比Y的大,所以Z为Cl元素。
[答案](1)
(1)Al(OH)3+OH- AlO2-+2H2O或Al(OH)3+OH-
AlO2-+2H2O或Al(OH)3+OH- [Al(OH)4]-
[Al(OH)4]-
(3)2A12O3(熔融) 4Al+3O2↑
4Al+3O2↑
(4)c(NH4+)>c(SO42-)>c(H+)>c(OH-) 3
(5)Cl2O7(l)+H2O(1) 2HClO4(aq) △H=-4akJ·mol -1
2HClO4(aq) △H=-4akJ·mol -1
(6)在氯水中存在如下平衡:Cl2+H2O H++Cl-+HClO,在饱和NaCl溶液中,
H++Cl-+HClO,在饱和NaCl溶液中,
c(Cl-)最大,该平衡逆向移动程度最大,Cl2溶解的最少,所以可以用饱和NaCl溶液法收集Cl2。
21.(2010·杭州模拟)下列说法中正确的是( )
A.核外电子排布完全相同的两种微粒,其化学性质一定相同
B.同周期的主族元素从左到右,非金属性逐渐增强,气态氢化物稳定性逐渐增强
C.元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素
D.原子最外层电子数大于4的元素一定是非金属元素
[解析]选BC。A项错误,如Na+和Ne核外电子排布相同,但化学性质不同;B项描述了同一周期元素性质的递变规律,正确;C项从ⅢB族到ⅡB族包括七个副族,占三个纵行的VⅢ族都是金属元素:C正确;D项最外层电子数大于4的元素如:Sn.Pb.Po.Bi等都是金属元素,故AD项错误。
20.(2010·河池模拟)短周期元素A、B、C原子序数依次递增,它们原子的最外层电子数之和为10。A与C在周期表中同主族,B原子最外层电子数等于A原子次外层电子数,则下列叙述正确的是( )。
A.原子半径A>B>C
B.A的氢化物的稳定性大于C的氢化物
C.B的氧化物的熔点比A的氧化物高
D.A与C可形成离子化合物
[解析]选BC。据题意可知B最外层电子数为2,则A、C最外层电子数为4.A、B、C原子序数递增,可推知A为C、B为Mg、C为Si,由此可判断。
19.(2010·宝鸡模拟)最近医学界通过用14C标记的C60发现一种C60的羟酸衍生物,在特定条件下可以通过断裂DNA抑制艾滋病毒的繁殖,则有关14C的正确叙述是( )。
A.与12C60的碳原子化学性质不同
B.与14N含的中子数相同
C.是12C60的同素异形体
D.与12C、13C互为同位素
[解析]选D。14C是由碳元素的一种同位素,原子核内有14-6=8个中子。12C60是碳元素原子组成的单质,与金刚石、石墨等属于同素异形体。同位素原子的中子数不同,但最外层电子数相同,故化学性质几乎完全相同。
18.(2010·杭州模拟)某酸根离子RO3-所含电子数比硝酸根离子NO3-的电子数多10,则下列说法正确的是( )。
①R原子的电子层数比N原子的电子层数多1 ②RO3-中R元素与NO3-中N元素的化合价相同 ③RO3-与NO3-只可能被还原,不可能被氧化 ④R和N不是同周期元素,但是同主族元素
A.①③④ B.①②④ C.①② D.③④
[解析]选C。RO3-比NO3-电子数多10,则R元素的一个原子比N元素一个原子多10个电子,即R元素的原子序数为17,Cl元素有3个电子层,比N原子多1个电子层,①正确;在ClO3-中的Cl元素与NO3-中N元素的化合价皆为+5价,②正确;
ClO3-中+5价氯元素,化合价既可升高又可降低,故③不正确;Cl元素位于第ⅦA族,N元素位于ⅤA族,显然④不正确。
17.(2010·宝鸡模拟)氯的原子序数为17,35Cl是氯的一种同位素,下列说法正确的
是( )。
A.35Cl原子所含质子数为18
B. mol的1H35Cl分子所含中子数约为6.02×1023
mol的1H35Cl分子所含中子数约为6.02×1023
C.3.5g的35Cl2气体的体积为1.12L
D.35Cl2气体的摩尔质量为70
[解析]选B。质子数=原子序数=17,A选项错误;1个1H35Cl分子含中子数为(0+35-17)=18个,所以 mol的该分子所含的中子数=
mol的该分子所含的中子数= mol×18×NA≈6.02×1023,B选项正确;气体摩尔体积必须在标况下为22.4L/mol,C选项错误;35Cl2摩尔质量为70g/mol,D选项错误。
mol×18×NA≈6.02×1023,B选项正确;气体摩尔体积必须在标况下为22.4L/mol,C选项错误;35Cl2摩尔质量为70g/mol,D选项错误。
16.(2010·余杭模拟)正确掌握好化学用语是学好化学的基础,下列有关表述正确的
是( )。
①CO2的比例模型:
②O原子的结构示意图:
③聚乙烯的结构简式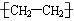
④次氯酸的结构式:H-Cl-O
⑤NH3的电子式: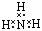
⑥明矾的化学式KAlSO412H2O
⑦作为相对原子质量测定标准的碳核素: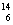 C
C
⑧碳酸氢根离子的电离方程式:HCO3-+H2O H3O++CO32-
H3O++CO32-
⑨铝热反应:2Al+3MgO Al2O3+3Mg
Al2O3+3Mg
⑩Fe3O4溶于氢碘酸的离子方程式:Fe3O4+8H+2Fe3++Fe2++4H2O
A.⑧ B.除⑥⑦外 C.除③⑥⑦⑨外 D.①④⑧⑨⑩
[解析]选A。碳原子的半径比氧原子的大,所以CO2的比例模型中应该是中间的球比两边的球大,①错误;O原子的结构示意图为 ,图中给的是其电子层结构示意图,②错误;聚乙烯是高分子化合物,其结构简式中漏掉了右下角的n,③错误;O可以形成2个共价键,而H和Cl只能形成1个共价键,所以次氯酸的结构式应为:
,图中给的是其电子层结构示意图,②错误;聚乙烯是高分子化合物,其结构简式中漏掉了右下角的n,③错误;O可以形成2个共价键,而H和Cl只能形成1个共价键,所以次氯酸的结构式应为:
H-O-Cl,④错误;NH3的电子式中漏掉了N原子的孤对电子,正确的电子式为: ,⑤错误;明矾的化学式是:KAl(SO4)2·12H2O,⑥错误;
,⑤错误;明矾的化学式是:KAl(SO4)2·12H2O,⑥错误; C作为相对原子质量测定标准,⑦错误;HCO3-电离显酸性,有H+或H3O+生成,水解显碱性,有
C作为相对原子质量测定标准,⑦错误;HCO3-电离显酸性,有H+或H3O+生成,水解显碱性,有
OH-生成,⑧正确;铝热反应是金属铝和比它不活泼的金属氧化物之间发生的置换反应,Mg比Al活泼,该反应不能发生,⑨错误;Fe3+具有氧化性,能够将氢碘酸中的
I-氧化成I2,⑩错误,其正确的离子方程式为:Fe3O4+8H++2I-3Fe2++I2+4H2O。
15.(2010·铜陵模拟)某元素最高价含氧酸的化学式为HxROy,则气态氢化物的化学式( )。
A.H8+x-2yR B.H8(2x+y)R C.H2x+8+yR D.RH8+x-2y
[解析]选AD。根据中性微粒化合价之和为0,元素的最高正价与最低负价的绝对值之和等于8求,由化学式HxROy可知,R的最高化合价为+(2y-x)价,则其最低负价为-[8-(2y-x)]=-(8+ x-2y)价。若R为VIA~VIIA族元素,则其气态氢化物的化学式为H8+x-2yR,若R为IVA~VA族元素,则其气态氢化物的化学式为
RH8+x-2y。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com