
4.新型无机非金属材料的特性
(1)能承受高温,强度高。例如:氮化硅陶瓷在1200℃左右的高温下,仍具有很高的硬度,可用来制造汽轮机叶片、轴承、永久模具等。
(2)具有电学特性。一些新型无机非金属材料可以作绝缘体,有的可作半导体、导体、超导体等。一些绝缘性材料常被用于做集成电路的基板。
(3)具有光学特性。有些新型无机非金属材料能发出单色的光,有的能透过可见光,有的能使红外线、雷达射线穿过。
(4)具有生物功能。一些新型无机非金属材料强度高、无毒、不溶于水,对人体组织有较好的适应性,可直接植于人体内,用这类材料制成的人造牙齿、人造骨骼,已被应用在医学上。
3.硅及其化合物的特殊性
(1)硅的还原性比碳强,而碳在高温下能从二氧化硅中还原出硅。
(2)非金属单质与强碱溶液反应一般不生成氢气,而硅与氢氧化钠等强碱溶液反应产生氢气。
(3)非金属单质一般不与非氧化性酸反应,而硅不但与氢氟酸反应,而且有氢气生成。
(4)酸性氧化物一般不与酸发生复分解反应,而二氧化硅却能与氢氟酸反应,生成四氟化硅和水。
(5)无机酸一般易溶于水,而硅酸和原硅酸却难溶于水。
(6)在水溶液中,碳酸的酸性比硅酸强,二氧化碳与硅酸钠反应生成碳酸钠和硅酸沉淀。在高温下碳酸钠与二氧化硅反应生成硅酸钠和二氧化碳,其原因是在高温条件下,生成的二氧化碳离开反应体系而使反应进行到底。
2.碳族元素的主要特征
在元素周期表中,碳族元素位于活泼金属(ⅠA族)向活泼非金属(ⅦA族)过渡的中间位置,其最外层电子数为4,既不容易得到电子,又不易失去电子,所以碳族元素的成键特征是易形成共价键,难形成离子键,特别是单个原子不能形成离子;单质以还原性为主,表现为难与H2生成气态氢化物,制取单质通常为还原法,如以C还原SiO2以制单质硅;碳元素形成的单质(金刚石)硬度最大;碳元素形成的化合物种类最多;在所有非金属形成的气态氢化物中,甲烷中氢元素的质量分数最大;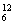 C是元素相对原子质量的标准原子;硅在地壳中的含量仅次于氧,其单质晶体是一种良好的半导体材料。
C是元素相对原子质量的标准原子;硅在地壳中的含量仅次于氧,其单质晶体是一种良好的半导体材料。
1.碳及其化合物间的转化关系
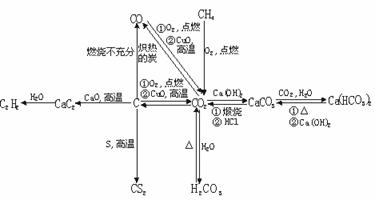
(1)会运用氧化还原反应知识规律分析理解碳、一氧化碳、二氧化碳之间的相互转化及应用。运用酸碱反应规律分析理解二氧化碳、碳酸正盐、碳酸氢盐(酸式盐)之间的相互转化及应用。
(2)碳酸盐性质规律
①溶解性规律:如果碳酸的正盐溶解度较大,则酸式盐的溶解度小[如:Na2CO3>NaHCO3];如果碳酸的正盐溶解度小,则对应酸式盐的溶解度较大[如:CaCO3<Ca(HCO3)2]
②稳定性:难溶性的碳酸盐,(NH4)2CO3及酸式盐受热易分解;可溶性的碳酸盐较稳定,受热难分解。
③酸式盐与碱反应时的产物要根据相对用量判断。如:在Ca(HCO3)2溶液中滴加NaOH溶液:
Ca(HCO3)2+NaOH===CaCO3↓+NaHCO3+H2O(NaOH少量)
Ca(HCO3)2+2NaOH===CaCO3↓+Na2CO3+2H2O(NaOH过量)
④CO 和HCO
和HCO 的检验:利用正盐和酸式盐的溶解性可区别CO
的检验:利用正盐和酸式盐的溶解性可区别CO 和HCO
和HCO ,如BaCl2溶液。利用CO
,如BaCl2溶液。利用CO 与H+反应产生CO2的方法,检验CO
与H+反应产生CO2的方法,检验CO 或HCO
或HCO 。
。
21.解答:(1)金刚石 金刚石属原子晶体,而固体C60不是,故金刚石熔点较高
(答出“金刚石属原子晶体”即给分)
(2)可能 因C60分子含30个双键,与极活泼的F2发生加成反应即可生成C60F60
(只要指出“C60含30个双键”即给分,但答“因C60含有双键”不给分)
(3)依题意,C60分子形式的化学键数为: (3×60)=90
(3×60)=90
也可由欧拉定理计算键数(即棱边数):60+(12+20)-2=90
C60分子中单键为:90-30=60
[答“2×30(双键数)=60”即给分]
(4)设C70分子中五边形数为x,六边形数为y。依题意可得方程组:

解得:五边形数x=12,六边形数y=25。?
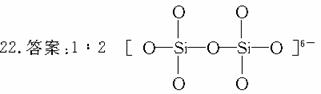
解析:从石英晶体的平面示意图可以看出:每个网眼由4个Si原子和4个O原子围成,但每个Si原子为4个网眼共有,而每个O原子由两个网眼共有,故n(Si)∶n(O)=(4× )∶
)∶
(4× )=1∶2。双二聚硅酸为两分子硅酸(H4SiO4)去水形成,即:
)=1∶2。双二聚硅酸为两分子硅酸(H4SiO4)去水形成,即:

●命题趋向与应试策略
20.答案:(1)CuCO3·Cu(OH)2 2CuCO3·Cu(OH)2
(2)CuCO3·Cu(OH)2和2CuCO3·Cu(OH)2的混合物
(3)36 (4)( )
)
解析:(1)依题意知:
孔雀石中, =
=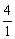 解得:
解得: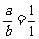
石青中: =
= 解得:
解得:
所以,在a≤2,b≤2时,
孔雀石化学式为CuCO3·Cu(OH)2;石青化学式为:2CuCO3·Cu(OH)2
(2)n(CO2)= =0.15 mol=n(CuCO3)
=0.15 mol=n(CuCO3)
n(CuO)= =0.25 mol=n(CuCO3)+n[Cu(OH)2]
=0.25 mol=n(CuCO3)+n[Cu(OH)2]
所以,n[Cu(OH)2]=0.25 mol-0.15 mol=0.10 mol
a∶b=n(CuCO3)∶n[Cu(OH)2]=0.15 mol∶0.1 mol=3∶2
因为a≤2,b≤2,
所以,该矿样混合物的化学组成为CuCO3·Cu(OH)2和2CuCO3·Cu(OH)2的混合物。
(3)对aCuCO3·bCu(OH)2矿样
 =
=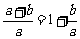
比值最低的是2CuCO3·Cu(OH)2 (a=2,b=1)
已知n(CO2)= =0.3 mol=a
=0.3 mol=a
n(CuO)=[(a+b)/a]·n(CO2)=0.45 mol
m(CuO)=0.45 mol×80 g·mol-1=36 g
(4)A=124× +98(
+98( )
)
19.答案:核内中子数(或“14C中子数多2个”,或:“原子质量数”) C
18.答案:将CO中毒者移至新鲜空气处,并设法改善中毒者缺氧的状态(例如人工呼吸等)。
解析:人体血液中的血红蛋白既能与O2结合,也能与CO结合,且更易结合CO,使血液失去运输氧气的功能,使人缺氧而中毒。从平衡移动的观点,应让中毒者离开CO的环境,移至新鲜空气处,并设法改善中毒者缺氧的状态。
17.答案:A
解析:“SiO2”不是由单个的“SiO2”的分子所组成的,它是一种原子晶体。1个Si原子跟4个O原子形成了4个共价键,这样,每1个Si原子周围结合4个O原子,同时每个O原子跟两个Si原子相结合。实际上,二氧化硅晶体是由硅原子和氧原子按1∶2的比例所组成的立体网状的原子晶体,通常用“SiO2”表示二氧化硅的组成。而SO2、CO2、CS2皆为分子晶体。故存在分子。
16.答案:A
解析:CO2通入CaCl2溶液中产生的CaCO3能溶于反应生成的盐酸中,故此反应不能发生,也无沉淀生成,故选A。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com