
与碳相似,有晶体和无定形两种。晶体硅结构类似于金刚石,有金属光泽的灰黑色固体,熔点高(1410℃),硬度大,较脆,常温下化学性质不活泼。是良好的半导体,应用:半导体晶体管及芯片、光电池、
硅酸盐是由硅、氧、金属元素组成的化合物的总称,分布广,结构复杂化学性质稳定。一般不溶于水。(Na2SiO3 、K2SiO3除外)最典型的代表是硅酸钠Na2SiO3 :可溶,其水溶液称作水玻璃和泡花碱,可作肥皂填料、木材防火剂和黏胶剂。 常用硅酸盐产品:玻璃、陶瓷、水泥
酸性很弱(弱于碳酸)溶解度很小,由于SiO2不溶于水,硅酸应用可溶性硅酸盐和其他酸性比硅酸强的酸反应制得。
Na2SiO3+2HCl == H2SiO3↓+2NaCl
硅胶多孔疏松,可作干燥剂,催化剂的载体。
天然存在的二氧化硅称为硅石,包括结晶形和无定形。石英是常见的结晶形二氧化硅,其中无色透明的就是水晶,具有彩色环带状或层状的是玛瑙。二氧化硅晶体为立体网状结构,基本单元是[SiO4],因此有良好的物理和化学性质被广泛应用。(玛瑙饰物,石英坩埚,光导纤维)
物理:熔点高、硬度大、不溶于水、洁净的SiO2无色透光性好
化学:化学稳定性好、除HF外一般不与其他酸反应,可以与强碱(NaOH)反应,是酸性氧化物,在一定的条件下能与碱性氧化物反应
SiO2+4HF == SiF4 ↑+2H2O
SiO2+CaO === CaSiO3
SiO2+2NaOH == Na2SiO3+H2O
不能用玻璃瓶装HF,装碱性溶液的试剂瓶应用木塞或胶塞。
素,以熔点很高的氧化物及硅酸盐形式存在于岩石、沙子和土壤中,占地壳质量90%以上。位于第3周期,第ⅣA族碳的下方。
Si 对比 C

最外层有4个电子,主要形成四价的化合物。
|
|
碳酸钠 |
碳酸氢钠 |
|
俗名 |
纯碱或苏打 |
小苏打 |
|
色态 |
白色晶体 |
细小白色晶体 |
|
水溶性 |
易溶于水,溶液呈碱性使酚酞变红 |
易溶于水(但比Na2CO3溶解度小)溶液呈碱性(酚酞变浅红) |
|
热稳定性 |
较稳定,受热难分解 |
受热易分解 2NaHCO3  Na2CO3+CO2↑+H2O Na2CO3+CO2↑+H2O |
|
与酸反应 |
CO32-+H+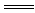 H CO3- H CO3-H CO3-+H+ 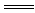 CO2↑+H2O CO2↑+H2O |
H CO3-+H+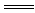 CO2↑+H2O CO2↑+H2O相同条件下放出CO2的速度NaHCO3比Na2CO3快 |
|
与碱反应 |
Na2CO3+Ca(OH)2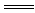 CaCO3↓+2NaOH CaCO3↓+2NaOH反应实质:CO32-与金属阳离子的复分解反应 |
NaHCO3+NaOH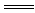 Na2CO3+H2O Na2CO3+H2O反应实质:H CO3-+OH- 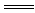 H2O+CO32- H2O+CO32- |
|
与H2O和CO2的反应 |
Na2CO3+CO2+H2O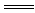 2NaHCO3 2NaHCO3CO32-+H2O+CO2 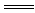 H CO3- H CO3- |
不反应 |
|
与盐反应 |
CaCl2+Na2CO3 CaCO3↓+2NaCl CaCO3↓+2NaClCa2++CO32-  CaCO3↓ CaCO3↓ |
不反应 |
|
主要用途 |
玻璃、造纸、制皂、洗涤 |
发酵、医药、灭火器 |
|
转化关系 |
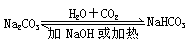 |
A12O3为两性氧化物,Al(OH)3为两性氢氧化物,都既可以与强酸反应生成盐和水,也可以与强碱反应生成盐和水。
金属活动性Na>Mg>Al>Fe。
3、氧化还原反应中概念及其相互关系如下:
失去电子--化合价升高--被氧化(发生氧化反应)--是还原剂(有还原性)
得到电子--化合价降低--被还原(发生还原反应)--是氧化剂(有氧化性)
2、离子反应
(1)、电解质:在水溶液中或熔化状态下能导电的化合物,叫电解质。酸、碱、盐都是电解质。在水溶液中或熔化状态下都不能导电的化合物,叫非电解质。
注意:①电解质、非电解质都是化合物,不同之处是在水溶液中或融化状态下能否导电。②电解质的导电是有条件的:电解质必须在水溶液中或熔化状态下才能导电。③能导电的物质并不全部是电解质:如铜、铝、石墨等。④非金属氧化物(SO2、SO3、CO2)、大部分的有机物为非电解质。
(2)、离子方程式:用实际参加反应的离子符号来表示反应的式子。它不仅表示一个具体的化学反应,而且表示同一类型的离子反应。
复分解反应这类离子反应发生的条件是:生成沉淀、气体或水。书写方法:
写:写出反应的化学方程式
拆:把易溶于水、易电离的物质拆写成离子形式
删:将不参加反应的离子从方程式两端删去
查:查方程式两端原子个数和电荷数是否相等
(3)、离子共存问题
所谓离子在同一溶液中能大量共存,就是指离子之间不发生任何反应;若离子之间能发生反应,则不能大量共存。
A、结合生成难溶物质的离子不能大量共存:如Ba2+和SO42-、Ag+和Cl-、Ca2+和CO32-、Mg2+和OH-等
B、结合生成气体或易挥发性物质的离子不能大量共存:如H+和C O 32-,HCO3-,SO32-,OH-和NH4+等
C、结合生成难电离物质(水)的离子不能大量共存:如H+和OH-、CH3COO-,OH-和HCO3-等。
D、发生氧化还原反应、水解反应的离子不能大量共存(待学)
注意:题干中的条件:如无色溶液应排除有色离子:Fe2+、Fe3+、Cu2+、MnO4-等离子,酸性(或碱性)则应考虑所给离子组外,还有大量的H+(或OH-)。
(4)离子方程式正误判断(六看)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com