
氨气的性质:无色气体,刺激性气味、密度小于空气、极易溶于水(且快)1:700体积比。溶于水发生以下反应使水溶液呈碱性:NH3+H2O
 NH3·H2O
NH3·H2O  NH4++OH- 可作红色喷泉实验。生成的一水合氨NH3·H2O是一种弱碱,很不稳定,会分解,受热更不稳定:NH3·H2O
=== NH3 ↑+H2O
NH4++OH- 可作红色喷泉实验。生成的一水合氨NH3·H2O是一种弱碱,很不稳定,会分解,受热更不稳定:NH3·H2O
=== NH3 ↑+H2O
浓氨水易挥发除氨气,有刺激难闻的气味。
氨气能跟酸反应生成铵盐:NH3+HCl == NH4Cl (晶体)
氨是重要的化工产品,氮肥工业、有机合成工业及制造硝酸、铵盐和纯碱都离不开它。氨气容易液化为液氨,液氨气化时吸收大量的热,因此还可以用作制冷剂。
铵盐的性质:易溶于水(很多化肥都是铵盐),受热易分解,放出氨气:
NH4Cl 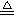 NH3 ↑+HCl ↑
NH3 ↑+HCl ↑
NH4HCO3 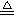 NH3 ↑+H2O ↑+CO2 ↑
NH3 ↑+H2O ↑+CO2 ↑
可以用于实验室制取氨气:(干燥铵盐与和碱固体混合加热)
NH4NO3+NaOH 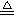 Na NO3+H2O+NH3 ↑
Na NO3+H2O+NH3 ↑
2NH4Cl+Ca(OH)2 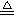 CaCl2+2H2O+2NH3 ↑
CaCl2+2H2O+2NH3 ↑
用向下排空气法收集,红色石蕊试纸检验是否收集满。
小结:SiO2+4HF == SiF4 ↑+2H2O
SiO2+CaO === CaSiO3
SiO2+2NaOH == Na2SiO3+H2O
Na2SiO3+2HCl == H2SiO3+2NaCl
2Na+Cl2 === 2NaCl 2Fe+3Cl2 ===2FeCl3 Cu+Cl2 ===CuCl2 Cl2+H2 === 2HCl
Cl2+H2O=HCl+HClO 2HClO === 2HCl+O2 ↑
Cl2+2NaOH == NaCl+NaClO+H2O
2Cl2+2Ca(OH)2 == CaCl2+Ca(ClO)2+2H2O
HCl+AgNO3 == AgCl ↓+HNO3
NaCl+AgNO3 == AgCl ↓+NaNO3
Na2CO3+2AgNO3 ==Ag2CO3 ↓+2NaNO3
Ag2CO3+2HNO3 == 2AgNO3+CO2 ↑+H2O
Cl-+Ag+ == AgCl ↓
S+O2 === SO2 SO2+H2O  H2SO3
H2SO3
N2+O2 ======== 2NO 2NO+O2 == 2NO2 3 NO2+H2O == 2HNO3+NO
2 SO2+O2  2SO3 SO3+H2O=H2SO4
2SO3 SO3+H2O=H2SO4
2 H2SO4
(浓)+Cu 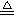 CuSO4+2H2O+SO2 ↑
CuSO4+2H2O+SO2 ↑
2 H2SO4
(浓)+C 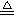 CO2 ↑+2H2O+SO2 ↑
CO2 ↑+2H2O+SO2 ↑
4HNO3(浓)+Cu == Cu(NO3)2+2NO2 ↑+4H2O
8HNO3(稀)+3Cu 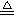 3Cu(NO3)2+2NO ↑+4H2O
3Cu(NO3)2+2NO ↑+4H2O
NH3·H2O
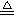 NH3 ↑+H2O NH3+HCl=NH4Cl
NH3 ↑+H2O NH3+HCl=NH4Cl
NH3+H2O  NH3·H2O
NH3·H2O
 NH4++OH-
NH4++OH-
即NH3+H2O  NH4++OH-
NH4++OH-
NH4Cl
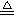 NH3 ↑+HCl ↑
NH3 ↑+HCl ↑
NH4HCO3
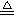 NH3 ↑+H2O ↑+CO2 ↑
NH3 ↑+H2O ↑+CO2 ↑
NH4NO3+NaOH 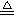 Na NO3+H2O+NH3 ↑
Na NO3+H2O+NH3 ↑
2NH4Cl+Ca(OH)2 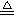 CaCl2+2H2O+2NH3 ↑
CaCl2+2H2O+2NH3 ↑
物理性质:无色液体,易挥发,沸点较低,密度比水大。
化学性质:具有一般酸的通性,浓硝酸和稀硝酸都是强氧化剂。还能氧化排在氢后面的金属,但不放出氢气。
4HNO3(浓)+Cu == Cu(NO3)2+2NO2 ↑+4H2O
8HNO3(稀)+3Cu 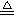 3Cu(NO3)2+2NO ↑+4H2O
3Cu(NO3)2+2NO ↑+4H2O
反应条件不同,硝酸被还原得到的产物不同,可以有以下产物:NO2,HNO2,NO,N2O,N2, NH3△硫酸和硝酸:浓硫酸和浓硝酸都能钝化某些金属(如铁和铝)使表面生成一层致密的氧化保护膜,隔绝内层金属与酸,阻止反应进一步发生。因此,铁铝容器可以盛装冷的浓硫酸和浓硝酸。硝酸和硫酸都是重要的化工原料和实验室必备的重要试剂。可用于制化肥、农药、炸药、染料、盐类等。硫酸还用于精炼石油、金属加工前的酸洗及制取各种挥发性酸。
物理性质:无色粘稠油状液体,不挥发,沸点高,密度比水大。
化学性质:具有酸的通性,浓硫酸具有脱水性、吸水性和强氧化性。是强氧化剂。
C12H22O11 ====== 12C+11H2O放热
2 H2SO4
(浓)+C 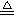 CO2 ↑+2H2O+SO2 ↑
CO2 ↑+2H2O+SO2 ↑
还能氧化排在氢后面的金属,但不放出氢气。
2 H2SO4
(浓)+Cu 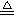 CuSO4+2H2O+SO2 ↑
CuSO4+2H2O+SO2 ↑
稀硫酸:与活泼金属反应放出H2 ,使酸碱指示剂紫色石蕊变红,与某些盐反应,与碱性氧化物反应,与碱中和
SO2 、NO2溶于雨水形成酸雨。防治措施:
① 从燃料燃烧入手。
② 从立法管理入手。
③从能源利用和开发入手。
④从废气回收利用,化害为利入手。
(2SO2+O2 2SO3 SO3+H2O= H2SO4)
2SO3 SO3+H2O= H2SO4)
一氧化氮在自然界形成条件为高温或放电:N2+O2 ======== 2NO,生成的一氧化氮很不稳定,在常温下遇氧气即化合生成二氧化氮: 2NO+O2 == 2NO2
一氧化氮的介绍:无色气体,是空气中的污染物,少量NO可以治疗心血管疾病。
二氧化氮的介绍:红棕色气体、刺激性气味、有毒、易液化、易溶于水,并与水反应:
3 NO2+H2O == 2HNO3+NO 这是工业制硝酸的方法。
制法(形成):硫黄或含硫的燃料燃烧得到(硫俗称硫磺,是黄色粉末)
S+O2 === SO2
物理性质:无色、刺激性气味、容易液化,易溶于水(1:40体积比)
化学性质:有毒,溶于水与水反应生成亚硫酸H2SO3,形成的溶液酸性,有漂白作用,遇热会变回原来颜色。这是因为H2SO3不稳定,会分解回水和SO2
SO2+H2O  H2SO3
因此这个化合和分解的过程可以同时进行,为可逆反应。
H2SO3
因此这个化合和分解的过程可以同时进行,为可逆反应。
可逆反应--在同一条件下,既可以往正反应方向发生,又可以向逆反应方向发生的化学反应称作可逆反应,用可逆箭头符号 连接。
连接。
使用硝酸银溶液,并用稀硝酸排除干扰离子(CO32-、SO32-)
HCl+AgNO3 == AgCl ↓+HNO3
NaCl+AgNO3 == AgCl ↓+NaNO3
Na2CO3+2AgNO3 ==Ag2CO3 ↓+2NaNO3
Ag2CO3+2HNO3 == 2AgNO3+CO2 ↑+H2O
Cl-+Ag+ == AgCl ↓
物理性质:黄绿色气体,有刺激性气味、可溶于水、加压和降温条件下可变为液态(液氯)和固态。
制法:MnO2+4HCl
(浓)  MnCl2+2H2O+Cl2
MnCl2+2H2O+Cl2
闻法:用手在瓶口轻轻扇动,使少量氯气进入鼻孔。
化学性质:很活泼,有毒,有氧化性, 能与大多数金属化合生成金属氯化物(盐)。也能与非金属反应:
2Na+Cl2 === 2NaCl 2Fe+3Cl2=== 2FeCl3 Cu+Cl2=== CuCl2
Cl2+H2 === 2HCl 现象:发出苍白色火焰,生成大量白雾。
燃烧不一定有氧气参加,物质并不是只有在氧气中才可以燃烧。燃烧的本质是剧烈的氧化还原反应,所有发光放热的剧烈化学反应都称为燃烧。
Cl2的用途:
①自来水杀菌消毒Cl2+H2O == HCl+HClO 2HClO === 2HCl+O2 ↑
1体积的水溶解2体积的氯气形成的溶液为氯水,为浅黄绿色。其中次氯酸HClO有强氧化性和漂泊性,起主要的消毒漂白作用。次氯酸有弱酸性,不稳定,光照或加热分解,因此久置氯水会失效。
②制漂白液、漂白粉和漂粉精
制漂白液 Cl2+2NaOH=NaCl+NaClO+H2O ,其有效成分NaClO比HClO稳定多,可长期存放制漂白粉(有效氯35%)和漂粉精(充分反应有效氯70%) 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
③与有机物反应,是重要的化学工业物质。
④用于提纯Si、Ge、Ti等半导体和钛
⑤有机化工:合成塑料、橡胶、人造纤维、农药、染料和药品
氯离子Cl-,为典型的非金属元素,在自然界中以化合态存在。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com