
11.(2010·海口模拟)把100g某NaOH溶液(密度是1.2g/mL)蒸发浓缩,余下50mL
溶液时,物质的量浓度为8mol/L,原溶液的浓度是( )。
A.8mol/L B.4.8mol/L C.3.3mol/L D.16mol/L
[解析]选B。蒸发浓缩前后,NaOH的物质的量不变。n(NaOH)=8mol/L×0.050L=0.4mol,蒸发浓缩前溶液的体积为:V(NaOH)=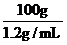 ×
×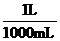 =
=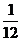 L,所以c(NaOH)=
L,所以c(NaOH)=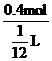 =4.8mol/L。
=4.8mol/L。
10.(2010·长沙模拟)密度为rg / cm3的溶液VmL,含有相对分子质量为M的溶质mg,其物质的量浓度为cmol/L,质量分数为w%,下列表示式不正确的是( )。
A.c=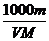 B.m=
B.m=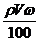 C.r=
C.r=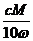 D.w%=
D.w%=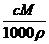 %
%
[解析]选D。A选项是由浓度定义公式得到,B选项可写成m=VmL×rg / cm3×w%,C选项可表示为c=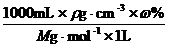 ,D选项应为
,D选项应为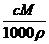 ×100%。
×100%。
1.6gX与Y完全反应后,生成4.4g R,则参与反应的Y和生成物Q的质量比为( )。
A.46∶9 B.32∶9 C.23∶9 D.16∶9
[解析]选D。生成的Q和R质量比为:m(Q)∶m(R)=2M(Q)∶M(R)=(2×9)∶22=9∶11,所以m(Q)=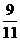 m(R)=
m(R)=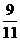 ×4.4g=3.6g。根据质量守恒定律:m(Y)=m(Q)+ m(R)-m(X)=3.6g+4.4g-1.6g=6.4g,所以m(Y)∶m(Q)=6.4g∶3.6g=16∶9。
×4.4g=3.6g。根据质量守恒定律:m(Y)=m(Q)+ m(R)-m(X)=3.6g+4.4g-1.6g=6.4g,所以m(Y)∶m(Q)=6.4g∶3.6g=16∶9。
9.(2010·盐城模拟)已知Q与R的摩尔质量之比为9∶22。在反应X+2Y=2Q+R中,当
8.(2010·通州模拟)在臭氧发生装置中装入氧气100mL,经反应:3O2 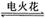 2O3,最后气体体积变为95mL(体积均在标准状况下测定),则混合气体的密度是( )。
2O3,最后气体体积变为95mL(体积均在标准状况下测定),则混合气体的密度是( )。
A.1.3g/L B.1.5g/L C.1.7g/L D.2.0g/L
[解析]选B。ρ(O2)=32g·mol-1÷22.4mol·L-1=1.429g·L-1,根据同温同压下同质量的气体,密度之比等于体积的反比,可得:ρ(混)=V(O2)·ρ(O2)/V(混)=1.429g·L-1×100mL÷95mL=1.50g·L-1。
7.(2010·玉溪模拟)三个容积不同的密闭容器中分别充满O2、N2、CH4三种气体,当这些容器内的气体温度和密度均相等时,这三个密闭容器内单位体积所含分子数的相互关系正确的是( )。
A.n(O2)>n(CH4)>n(N2) B.n(O2)>n(N2)>n(CH4)
C.n(CH4)>n(N2)>n(O2) D.n(O2)=n(N2)=n(CH4)
[解析]选C。根据ρ=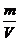 ,因为温度和密度均相等,所以单位体积的三种气体的质量也相同;由n=
,因为温度和密度均相等,所以单位体积的三种气体的质量也相同;由n=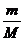 ,相同质量的气体,摩尔质量越大,物质的量越小,所含分子数越小。
,相同质量的气体,摩尔质量越大,物质的量越小,所含分子数越小。
6.(2010·唐山模拟)设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )。
A.28g乙烯和28g丙烯中均含有6NA对共用电子对
B.在熔融状态下,lmol NaHSO4完全电离出的阳离子数目为2NA
C.7.8g Na2O2含有的阴离子数目为0.2 NA
D.在含4mol Si-O键的石英晶体中,氧原子的数目为4NA
[解析]选A。A中的干扰是乙烯和丙烯中的键数不等,但实质上当两者质量相同时,含有的C、H原子数相同,因而共用电子对数当然也就相同,正确;熔化状态下能电离的只能是原有的离子键,所以形成的是Na+、HSO4-即阳离子为NA;C项中的氧原子个数起干扰作用,实质上两个氧原子共同形成一个过氧根离子O22-,即为0.1 NA;在二氧化硅晶体中每有一个Si就形成4个硅氧键,所以含4molSi-O键时,为1mol硅原子,对应的就为2NA氧原子。
5.(2010·天津模拟)设NA为阿伏加德罗常数,下列说法不正确的是( )。
A.1mol O2与金属钠反应,O2不一定得到4NA个电子
B.标准状况下,a L CH4和a L C6H14中所含分子数均为a NA/22.4
C.常温常压下,1mol氯气与足量的金属镁反应,转移2NA个电子
D.在20℃、1.01×105 Pa时,2.8g C2H4和CO的混合气体含气体分子数等于0.1 NA
[解析]选B。A选项,当O2与钠反应生成Na2O2时,每mol O2只能得到2NA个电子,A正确;B选项,标准状况下C6H14为液态;D选项2.8g C2H4和CO的混合气体的物质的量为0.1mol,因此气体的分子数等于0.1 NA。C,D正确。
4.(2010·南京模拟)固体单质A和气体单质B在容积一定的密闭容器中完全反应生成气体C,同温下测得容器内压强不变,且反应后气体C的密度是原气体密度的4倍。则下列判断正确的是( )。
A.两种气体单质的摩尔质量比为1∶4
B.生成物C中A的质量分数为75%
C.生成物C中A、B的原子个数比为3∶1
D.反应前后气体分子数比为1∶4
[解析]选B。同温同压下,气体的密度之比等于摩尔质量之比,所以M(C)∶M(B)=4∶1,A选项错误;又因为容器的体积相同,所以C的质量是B的质量的4倍,即A元素的质量占其中的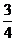 ,B选项正确;因为不知道A、B、C的化学式,所以无法确定反应前后A、B的原子个数比,C选项错误;根据阿伏加德罗定律,同温同压下,同体积的气体的物质的量相同,则B和C的化学计量数相同,即反应前后气体分子数比为1∶1,D选项错误。
,B选项正确;因为不知道A、B、C的化学式,所以无法确定反应前后A、B的原子个数比,C选项错误;根据阿伏加德罗定律,同温同压下,同体积的气体的物质的量相同,则B和C的化学计量数相同,即反应前后气体分子数比为1∶1,D选项错误。
3.(2010·芜湖模拟)如图两瓶体积相等的气体,在同温同压时瓶内气体的关系一定正确的是( )。
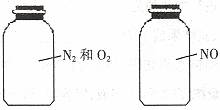
A.所含原子数相等 B.气体密度相等
C.气体质量相等 D.摩尔质量相等
[解析]选A。根据pV=nRT=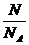 RT,在同温同压时,气体的体积和物质的量成正比,和分子数也成正比,所以相同体积的气体物质的量相同,分子数也相同,又因为所给的气体都是双原子分子,所以所含的原子数也相等,A选项正确;因为同温同容下,气体的密度比等于摩尔质量之比,N2和O2只有在等物质的量混合时的平均摩尔质量等于NO的摩尔质量,根据
RT,在同温同压时,气体的体积和物质的量成正比,和分子数也成正比,所以相同体积的气体物质的量相同,分子数也相同,又因为所给的气体都是双原子分子,所以所含的原子数也相等,A选项正确;因为同温同容下,气体的密度比等于摩尔质量之比,N2和O2只有在等物质的量混合时的平均摩尔质量等于NO的摩尔质量,根据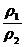 =
=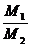 和ρ=
和ρ=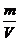 =
=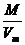 可以判断气体的质量和密度也不一定相等。
可以判断气体的质量和密度也不一定相等。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com