
4.沉淀的溶解
(1)对于在水中难溶的 ,如果能设法不断移去溶解平衡体系中的相应 ,使平衡向沉淀溶解的方向 ,就可以使沉淀溶解。
(2)CaCO3沉淀溶于盐酸中
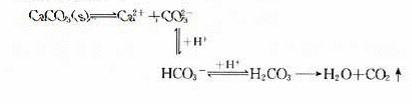
在上述反应中,CO2的生成和逸出,使CaCO3溶解平衡体系中的 浓度不断 ,平衡向
方向移动。
浓度不断 ,平衡向
方向移动。
(3)向3支盛有少量Mg(OH)2试管中分别滴加适量的蒸馏水、盐酸、氯化铵溶液,观察现象
|
滴加试剂 |
蒸馏水 |
盐酸 |
氯化铵溶液 |
|
现象 |
|
|
|
|
有关反应式 |
|
|
|
3.沉淀反应的应用
(1)在某些工业领域中,常用生成 来达到分离或除去某些离子的目的。
(2)如何除去工业原料氯化铵中的杂质氯化铁?
(3)要除去某溶液中的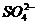 离子,加入可溶性钙盐还是钡盐?为什么?
离子,加入可溶性钙盐还是钡盐?为什么?
(4)判断能否生成沉淀应从哪几个方面考虑?是否可以使要除去的离子全部通过沉淀除去?
2.溶解平衡的特征:
生成沉淀的离子反应的本质
1.Ag+和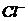 的反应能进行到底吗?
的反应能进行到底吗?
(1)溶解度和溶解性,难溶电解质和易溶电解质之间并无 的界限,浴解度小于 的称为难溶电解质,离子相互反应生成 ,可以认为是完全反应。
(2)根据对溶解度及反应限度、化学平衡原理的认识,说明生成沉淀的离子反应是否真正能进行到底?
AgCl在溶液中存在两个过程,一方面,在水分子作用下,少量
脱离AgCl表面溶入水中;另一方面,溶液中的
受AgCl表面正负离子的 ,回到AgCl的表面析出
。一定温度下,AgCl饱和溶液建立下列动态平衡的反应式:AgCl(s)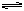
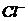 (aq)+Ag(aq)沉淀、溶解之间由于动态平衡的存住,决定了
反应不能完全进行到底。
(aq)+Ag(aq)沉淀、溶解之间由于动态平衡的存住,决定了
反应不能完全进行到底。
3.知道沉淀溶解平衡在生产、生活中的应用(沉淀的生成和分步沉淀,沉淀的溶解和转化)。
知识梳理
2.知道沉淀转化的本质。
1.知道难溶物在水中的溶解情况及沉淀溶解平衡的建立过程,能描述沉淀溶解平衡。
已知角θ的终边上一点P的坐标是(x,–2)(x≠0),且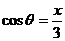 ,求sinθ和tanθ的值.
,求sinθ和tanθ的值.
分析: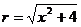 ,又
,又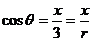 ,即rx=3x
,即rx=3x
由于x≠0,∴r=3 ∴x2+4=9 x2=5,x=±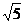 .
.
当x=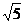 时,P点的坐标是(
时,P点的坐标是(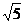 ,-2).
,-2).
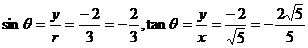
当x=-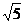 时,P点的坐标是(-
时,P点的坐标是(-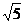 ,-2)
,-2)
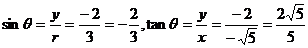 .
.
答案:当x=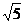 时,
时,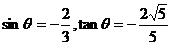
当x=–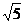 时,
时,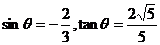
2.角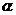 的终边上一个点P的坐标为(5a,-12a)(a≠0),求sin
的终边上一个点P的坐标为(5a,-12a)(a≠0),求sin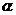 +2cos
+2cos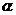 的值.
的值.
解:依题意得:x=5a,y=-12a,
∴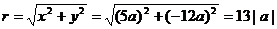
(1)当a>0时,角α是第四象限角,则
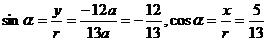 ,
,
∴sin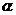 +2cos
+2cos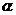 =-
=-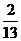 ;
;
(2)当a<0时,角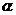 是第二象限角,则
是第二象限角,则
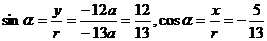 .
.
∴cos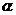 +2cos
+2cos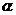 =
=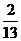 .
.
1.若点P(-3,y)是角α终边上一点,且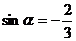 ,则y的值是 .答案:
,则y的值是 .答案: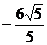
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com