
10、(2010·邯郸模拟)2008年北京奥运会“祥云”奥运火炬所用环保型燃料为丙烷(C3H8),悉尼奥运会所用火炬燃料为65%丁烷(C4H10)和35%丙烷,已知:
CO:2CO(g)+O2(g)=2CO2(g);△H=-566.0 kJ/mol。
丙烷:C3H8(g)+5O2(g)=3CO2(g)+4H2O(l);△H=-2221.5 kJ/mol。
正丁烷:C4H10(g)+6.5O2(g)=4CO2(g)+5H2O(l);△H=-2878.0kJ/mol。
异丁烷:C4H10(g)+6.5O2(g)=4CO2(g)+5H2O(l);△H=-2869.6kJ/mol。
下列有关说法正确的是( )
A.常温下,正丁烷的燃烧热为-2878.0kJ/mol
B.相同质量的丙烷和正丁烷分别完全燃烧,前者需要的氧气多,产生的热量也多
C.常温下,CO的燃烧热为566.0 kJ/mol
D.人类利用的能源都是通过化学反应获得的
[解析]选B。A项,常温下,正丁烷的燃烧热应为2878.0kJ/mol;B项,丙烷燃烧时丙烷的质量、产生的热量以及消耗的氧气分别为44 g,2221.5kJ/mol,5 mol,正丁烷燃烧时正丁烷的质量、产生的热量以及消耗的氧气分别为58 g,2878.0 kJ/mol,6.5 mol,所以相同质量的丙烷和正丁烷分别完全燃烧,前者需要的氧气多,产生的热量也多;C项,常温下,CO的燃烧热为283.0 kJ/mol ;D项,人类利用的能源可以不通过化学反应获得,如水力发电、风力发电、太阳能等。
2.2kJ。则Na2SO4溶液与BaCl2溶液反应的热化学方程式为( )
A.Ba2+(aq)+SO42-(aq)=BaSO4(s) △H=-2.92kJ·mol-1
B.Ba2+(aq)+SO42-(aq)=BaSO4(s) △H=-0.72kJ·mol-1
C.Ba2+(aq)+SO42-(aq)=BaSO4(s) △H=-73kJ·mol-1
D.Ba2+(aq)+SO42-(aq)=BaSO4(s) △H=-18kJ·mol-1
[解析]选D。硫酸与氢氧化钡溶液反应的放出的热量为5.12kJ,其中包含2个反应,一个是生成硫酸钡沉淀的反应,一个是生成水的反应,而氢氧化钡与盐酸反应只生成水,放出2.2kJ能量,但是生成水的量是第一个反应的1/2,放出的热量也是第一个反应的1/2,所以硫酸与0.04mol氢氧化钡反应生成0.04mol硫酸钡放出的热量为5.12-2.2×2=0.72kJ。所以生成1mol硫酸钡放出18kJ能量,故答案D正确。
9、(2010·晋中模拟)向足量H2SO4溶液中加入100mL 0.4 mol·L-1 Ba(OH)2溶液,放出的热
量是5.12kJ。如果向足量Ba(OH)2溶液中加入100mL 0.4 mol·L-1 HCl溶液时,放出的热量为
8、(2010·厦门模拟)中科大陈乾旺教授等人发明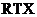 合成金刚石的新方法,化学原理为:
合成金刚石的新方法,化学原理为:
① (未配平)
(未配平)
该方法比1955年人工首次制得金刚石的旧方法容易得多,其化学原理是:
②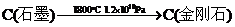 。
。
以下表述正确的是( )
A.反应①中既有旧化学键的断裂又有新化学键的形成
B.新方法利用的是化学变化,旧方法利用的是物理变化
C.在反应①中每生成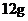 金刚石需要消耗
金刚石需要消耗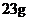 金属钠
金属钠
D.反应①和反应②中所得的金刚石都是还原产物
[解析]选A。B项,新方法和旧方法均发生了化合价的升降,为化学变化;C项方程式配平得8Na+6CO2=C(金刚石)+C(石墨)+4Na2CO3,所以生成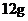 金刚石需要消耗23g×8=184g金属钠;D项②中化合价没有发生变化,所以金刚石不是还原产物。
金刚石需要消耗23g×8=184g金属钠;D项②中化合价没有发生变化,所以金刚石不是还原产物。
7、(2010·琼海模拟)一定条件下,充分燃烧一定量的丁烷放出热量161.9kJ,经测定完全吸收生成的CO2需消耗5 mol/L的KOH溶液100 ml,恰好生成正盐,则此条件下热化学方程式:C4H10(g) + 13/2 O2(g) → 4CO2(g) + 5 H2O(g)的△H为 ( )
A、+ 2590.4kJ/mol B、-2590.4kJ/mol
C、+ 1295.2kJ/mol D、-1295.2kJ/mol
[解析]选B。据题意,放出161.9kJ热量时生成的CO2的物质的量为5 mol/L×0.1L÷2=0.25 mol,所以△H=-161.9 kJ/mol×16=-2590.4kJ/mol
6、(2010·宁波模拟)已知下列反应的反应热为:
(1)CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) △H1=-870.3KJ/mol
(2)C(s)+O2(g)=CO2(g) △H2=-393.5KJ/mol
(3) H2(g)+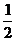 O2(g)=H2O(l)
△H3=-285.8KJ/mol
O2(g)=H2O(l)
△H3=-285.8KJ/mol
试计算下列反应的反应热:( )
2C(s)+2H2(g)+O2(g)=CH3COOH(l) △H
A.-488.3 KJ/mol B. +488.3KJ/mol C. -245.7KJ/mol D. +245.7KJ/mol
[解析]选A。根据盖斯定律,(2)×2+(3)×2-(1)可以得2C(s)+2H2(g)+O2(g)=CH3COOH(l),所以△H=△H2×2+△H3×2-△H1=-488.3 KJ/mol。
5、(2010·湖南师大附中模拟)已知反应:①101kPa时,2C(s)+O2(g)==2CO(g); ΔH=-221 kJ/mol ②稀溶液中,H+(aq)+OHˉ(aq)==H2O(l);ΔH=-57.3 kJ/mol 下列结论正确的是( )
A. ①表示2molC(s)燃烧生成2CO(g)需要吸收221 kJ的热量
B.碳的燃烧热大于110.5 kJ/mol
C.稀硫酸与浓NaOH溶液反应的中和热为-57.3 kJ/mol
D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量
[答案]B
4、(2010·潍坊模拟)已知通过乙醇制取氢气有如下两条路线:
a.CH3CH2OH(g)+H2O(g)→4H2(g)+2CO(g) △H= +255.6kJ·mol-1
b.CH3CH2OH(g)+1/2O2(g)→3H2(g)+2CO(g) △H= +13.8kJ·mol-1
则下列说法不正确的是( )
A.降低温度,可提高b路线中乙醇的转化率
B.从能量消耗的角度来看,b路线制氢更加有利
C.乙醇可通过淀粉等生物质原料发酵制得,属于可再生资源
D.由a、b知:2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ·mol-1
[解析]选A。b路线中反应为吸热反应,所以降低温度,平衡逆向移动,乙醇的转化率降低。
0.5 mol -121 kJ·mol-1
由上解得 ΔH=-484 kJ·mol-1
设1 mol H-H断裂吸收的热量为Q,则2Q+496 kJ-4×463 kJ=ΔH,故Q=436 kJ。
3、(2010·珠海模拟)已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ。且氧气中1 mol O=O键完全断裂时吸收热量496 kJ,水蒸气中1 mol H-O键形成时放出热量463 kJ,则氢气中1molH-H键断裂时吸收热量为( )
A.920 kJ B.557 kJ C.436 kJ D.188 kJ
[解析]选C.本题考查了反应热(焓变的计算方法)。由题意可得
2H2(g)+O2(g)===2H2O(g) ΔH
2 mol ΔH
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com