
28.答案:(1)NH4HCO3 NH3 O2
(2)C+4HNO3===2H2O+4NO2↑+CO2↑
27.答案:(1)Mg3N2+6H2O===2NH3↑+3Mg(OH)2 (2)17%
解析:解法一:设原混合物中Mg3N2的质量为x,由Mg3N2生成的MgO的质量为y
Mg3N2 3MgO
3MgO
100 120
x y
y=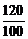 x? (0.470
g-x)+
x? (0.470
g-x)+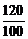 x=0.486 g
x=0.486 g
x=0.080 g
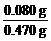 =17%
=17%
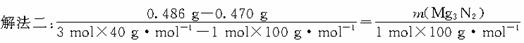
m(Mg3N2)=0.080 g
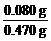 =17%
=17%
26.答案:(1)可能;AgNO3 (2)KNO3和Cu(NO3)2或KNO3、Cu(NO3)2和AgNO3。
解析:(1)4NO2+O2+2H2O===4HNO3
2AgNO3===2Ag+2NO2↑+O2↑
x mol x mol x/2 mol
生成气体的体积可表示为:V=3x/2。产物中x mol NO2与x/4
mol O2反应,余下x/4 mol O2,其体积表示为V′。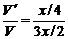 =1/6,符合题意。所以该固体物质可能是纯AgNO3。
=1/6,符合题意。所以该固体物质可能是纯AgNO3。
(2)若由KNO3和Cu(NO3)2按物质的量之比为1∶1组成的混合物也能符合题意。设KNO3和Cu(NO3)2分解得到的气体体积分别为V1和V2。V1/(V1+V2)=1/6 V2=5V1。由反应方程式①和②可知KNO3和Cu(NO3)2的物质的量之比为1∶1。(或由三种盐组成,其中KNO3和Cu(NO3)2的物质的量之比为1∶1,而AgNO3的物质的量可任意变动,这也符合题意)
25.答案:Ⅰ.①磷是叶绿体双层膜和基粒的构成成分 ②磷是ATP的成分,ATP在能量转换中起重要作用 ③磷是叶绿体DNA的构成成分
Ⅱ.(1)磷酸盐
白磷 红磷 (2)2P+3Cl2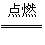 2PCl3 2P+5Cl2
2PCl3 2P+5Cl2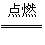 2PCl5
2PCl5
(3)188(空气中O2含量按21%计算)或197(空气中O2含量按约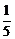 计算) (4)2
计算) (4)2
解析:此题的综合性很强,既有化学与生物的综合,也有无机化学和有机化学的综合,考查的知识是基本知识,题目难度不大。易出错点有两处,一处是第(2)磷在不充足的氯气中燃烧的化学方程式,有些考生认为氯气不足,产物应是PCl3,而忽略了PCl3更易被氯气氧化,因此,只写了第一步反应的方程式。第二处是第(4)双键数目,有些考生只注意P==S,而忽略了C==O。
24.答案:A
解析:应选择极易与NaOH反应(或说极易被NaOH吸收)的物质。其中只有A符合。B中的CH4,C中的CO,D中的NO本身都不与NaOH反应,故不选。
注:如是混合气,则NO2与NO又为等摩尔混合时也可进行喷泉实验。因NO2+NO+2NaOH===2NaNO2+H2O。
23.答案:B
解析:SO2、CO、NO都是污染大气的主要有害物质。SO2能使人发生呼吸道疾病,CO和NO能引起血红蛋白中毒,不会造成大气污染的是N2。
38.4×10-3 g/64 g·mol-1=0.6×10-3 mol,与浓硝酸反应若全部生成NO2气体,V(NO2)=0.6×10-3mol×2×22.4 L·mol-1/1=1.2×10-3×22.4 L。消耗n(HNO3)=(0.6×2+0.6×2)×10-3 mol=2.4×10-3 mol;
若全部生成NO气体,
V(NO)=(0.6×10-3mol×2×22.4 L·mol-1)/3=0.4×10-3×22.4 L,消耗n(HNO3)=(0.6×2+0.6/3×2)×10-3 mol=1.6×10-3 mol。已知生成22.4 mL气体,介于二者之间,所以生成的是NO、NO2的混合气体,消耗的HNO3的物质的量也应介于2.4×10-3 mol和1.6×
10-3 mol之间,所以选C。
解法二:仍然用上述方法判断22.4 mL气体的成分为NO、NO2混合气体。然后根据氮的物质的量反应前后守恒得出如下关系:
n(HNO3)=n[Cu(NO3)2]×2+n(NO2)+n(NO)
=n(Cu)×2+n(总气体)
=38.4×10-3 g/64 g·mol-1×2+22.4×10-3 L/22.4 L·mol-1
=2.2×10-3 mol
22.答案:C
解析:解法一:根据电子守恒Cu:
21.答案:BD
解析:选择b溶液极易吸收a气体且无其他气体生成的。NO2易与水反应但又生成NO,溶液不能充满烧瓶,Cl2在饱和NaCl中溶解度很小基本不被吸收。
20.答案:C
解析:由质量守恒定律知反应前后原子的个数与种类不变,所以可按反应前两种原子数目计算,又原子的物质的量之比等于原子个数之比,所以n(N)∶n(O)=a∶(a+2b),故选C。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com