
2.分析理解元素化合物性质的方法规律
(1)氮元素的化学活动性与氮分子的稳定性
元素的性质取决于元素的原子结构。氮的原子半径小,吸引电子的能力较强,故表现出较强的化学活动性,所以说氮元素是一种较为活泼的非金属元素。
氮气的稳定性则取决于氮分子的结构。氮分子是由两个氮原子共用三对电子结合而成的,氮分子中有共价三键(N≡N),它的键能很大(946 kJ·mol-1),当氮气参加化学反应时,必须打开(破坏)分子中的三键,这就需要吸收很高的能量。因此,在通常情况下,氮气的性质很不活泼,很难跟其他物质发生化学反应。只有在高温或放电条件下,氮分子获得了足够的能量,使氮分子中的共价键断裂而形成活动性较强的氮原子,才能跟氢气、氧气、金属等物质发生化学反应。
(2)由氨的分子结构分析理解氨的性质:NH3分子为三角锥形,N-H键具有极性,决定了NH3为极性分子,因而氨易液化(易液化的还有SO2、Cl2等);氨极易溶于水,其水溶液的密度小于1;NH3分子也极易与酸反应生成铵盐。
NH3分子中氮元素呈-3价,为氮元素的最低价态,具有还原性,能在一定条件下与O2、Cl2、CuO等反应,被它们氧化:
4NH3+5O2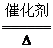 4NO+6H2O 2NH3+3Cl2===N2+6HCl
4NO+6H2O 2NH3+3Cl2===N2+6HCl
2NH3+3CuO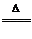 3Cu+N2+3H2O
3Cu+N2+3H2O
(3)关于硝酸性质的分析理解方法
①从属类去分析HNO3具有酸的通性。
②从硝酸中+5价氮元素去分析HNO3具有强氧化性,表现在能与多数金属、非金属、某些还原性化合物起反应。要注意,由于硝酸氧化性很强,任何金属与硝酸反应都不能放出氢气,在与不活泼金属如Cu、Ag等反应时,浓硝酸还原产物为NO2,稀HNO3还原产物为NO,(但不能认为稀HNO3的氧化性比浓硝酸强);在常温下,浓硝酸能使铁、铝等金属钝化;浓硝酸和浓盐酸体积之比为1∶3组成的混合物称为王水,氧化性很强,能氧化一些不溶于硝酸的金属,如:Pt、Au等。
③硝酸不稳定,易分解,受热、光照或浓度越大,硝酸越易分解。由于分解生成的NO2溶于硝酸而使硝酸呈黄色。实验室里为防止硝酸分解,常将硝酸盛放在棕色瓶内,贮放在黑暗而且温度低的地方。
1.氮及其化合物间的转化关系
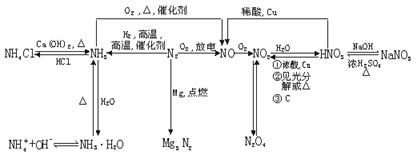
35.答案:(1)5 mol·L-1 (2)15.68 (3)16.8
解析:(1)从图上看出:34.4 g混合物和100 mL NaOH恰好完全反应。
因为1 mol NaOH-1 mol NH3即n(NaOH)=n(NH3)=11.2 L/22.4 L·mol-1=0.5 mol,c(NaOH)=n/V=0.5 mol/0.100 L=5 mol·L-1。
(2)V(NaOH)=140 mL,因为固体过量,
所以V(气)=22.4n(NaOH)=22.4×5×0.140=15.68(L)
(3)V(NaOH)=180 mL,过量,固体51.6 g,由图得出34.4 g/11.2 L=51.6 g/V(气),V(气)=16.8 L。
●命题趋向与应试策略
0.3 0.3 0.3
最终剩余PCl3 1 mol-0.3 mol=0.7 mol,n(PCl5)=0.3 mol。二者的物质的量之比为0.7∶0.3=7∶3。
(2)依题意知c(H+)=10-3 mol·L-1。设BaCl2溶液的摩尔浓度为c,加入H2SO4的体积为x mL,则由反应方程式:
BaCl2+H2SO4===BaSO4↓+2HCl
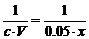 =
= 
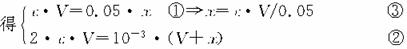
将③代入②解得c=5.05×10-4 mol·L-1
34.答案:(1)7∶3 (2)5.05×10-4
解析:(1)依据反应方程式计算如下:
2P+3Cl2=== 2PCl3
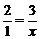 =
=
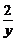
解得x=1.5(mol) y=1(mol)
由于Cl2过量1.8 mol-1.5 mol=0.3 mol,所以继续发生下面反应:
PCl3+Cl2 === PCl5
33.答案:N2(或氮气)
6NO2+8NH3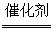 7N2+12H2O 6NO+4NH3
7N2+12H2O 6NO+4NH3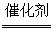 5N2+6H2O
5N2+6H2O
N2O3+2NaOH===2NaNO2+H2O (NO+NO2+2NaOH===2NaNO2+H2O)
解析:N元素的化合价:NO中为+2,NO2中为+4,NH3中为-3。发生氧化还原反应,其产物化合价应小于+2,大于-3,只能为零价,且N2稳定,无毒。故第一空可解。写方程式略。
32.答案:4NH3+6NO 5N2+6H2O
5N2+6H2O
解析:由题意NO中+2价氮作氧化剂,NH3中-3价的氮作还原剂,NO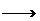 N2,但NH3的氧化产物没给。因该反应属同种元素间的氧化还原反应,所以-3价氮的氧化产物的化合价应介于-3和0之间(氧化产物价态不能高于还原产物的价态)。所以NH3
N2,但NH3的氧化产物没给。因该反应属同种元素间的氧化还原反应,所以-3价氮的氧化产物的化合价应介于-3和0之间(氧化产物价态不能高于还原产物的价态)。所以NH3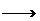 N2。如此反应物、生成物都已确定,即可写出该反应方程式。(同时要注意提高配平技能)
N2。如此反应物、生成物都已确定,即可写出该反应方程式。(同时要注意提高配平技能)
31.答案:(1)N3B3H6 (2)硼(B) 氢(H) (3)B2H6
解析:(1)B=81×40%÷10.8=3
H=81×7.4%÷1=6
N=(81-3×10.8-6)÷14=3
所以G的分子式为N3B3H6
(2)E含两种元素,由E+NH3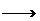
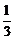 N3B3H6+2H2①可看出E一定含硼(B)元素,另一元素也只能为H或N。由反应①式看出反应后H原子数>3,故E中一定由B、H元素构成。
N3B3H6+2H2①可看出E一定含硼(B)元素,另一元素也只能为H或N。由反应①式看出反应后H原子数>3,故E中一定由B、H元素构成。
(3)由反应式①可知1 mol E和2 mol NH3恰好完全反应,反应式为
E+2NH3===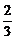 N3B3H6+4H2
N3B3H6+4H2
设E分子式为BxHy,由元素守恒得x=2 y=4+8-6=6
所以E分子式为B2H6
30.答案:Co(NH3)?6Cl3
解析:用n表示物质的量,用m表示质量。
n(NH3)=0.200 L×24.0×10-3 mol·L-1=4.80×10-3 mol
m(NH3)=4.8×10-3 mol×17 g·mol-1=8.16×10-2 g
n(Cl-)=0.100 mol·L-1×24.0×10-3 L=2.40×10-3 mol
m(Cl-)=2.40×10-3 mol×35.5 g·mol-1=8.52×10-2 g
m(Co)=0.2140 g-8.16×10-2 g-8.52×10-2 g=4.72×10-2 g
n(Co)=4.72×10-2 g/58.9 g·mol-1=8.01×10-4 mol
所以n(Co)∶n(NH3)∶n(Cl-)=1∶6∶3
即化学式为Co(NH3)6Cl3。
29.答案:(1)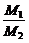 =0.60 (2)增大
=0.60 (2)增大
解析:由题意可知,蒸馏前后溶液质量不变。所以
M1+M2=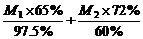
解得:M1∶M2=0.60;
(2)M1+M2=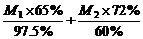 +0.05(M1+M2)
+0.05(M1+M2)
解得:M1/M2=15/17>0.6。?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com