
17.(12分)选择合适的化学用语的代号,填写在各小题的横线上。
下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。
|
b |
|
|
|||||||||||||||
|
|
|
|
|
h |
|
j |
|
|
|||||||||
|
a |
c |
f |
|
i |
|
l |
m |
||||||||||
|
|
|
|
e |
|
|
|
|
|
|
|
|
|
g |
|
|
|
|
|
|
d |
|
|
|
|
|
|
|
|
|
|
|
|
|
k |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(1)下列 (填写编号)组元素的单质可能都是电的良导体。
①a、c、h ②b、g、k ③g、m、1 ④d、e、f
(2)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去。核外电子离开该原子或离子所需要的能量主要受两大因素的影响:
Ⅰ.原子核对核外电子的吸引力 Ⅱ.形成稳定结构的倾向
下表是一些气态原子失去核外不同电子所需的能量(kJ·mol-1):
|
|
锂 |
X |
Y |
|
失去第一个电子 |
519 |
502 |
580 |
|
失去第二个电子 |
7296 |
4570 |
1820 |
|
失去第三个电子 |
11799 |
6920 |
2750 |
|
失去第四个电子 |
|
9550 |
11600 |
①通过上述信息和表中的数据分析为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量: 。
②表中X可能为以上13种元素中的 (填写字母)元素。用元素符号表示X和j常温下形成化合物的化学式 。
③Y是周期表中 族元素。
 ④以上13种元素中, (填写字母)元素原子失去核外第一个电子需要的能量最多。
④以上13种元素中, (填写字母)元素原子失去核外第一个电子需要的能量最多。
16.阿伏加德罗常数约为6.02×1023mol-1,下列叙述正确的是
A.2.24LCO2中含有的原子数为0.3×6.02×1023
B.0.1L 3mol·L-1的NH4NO3溶液中含有的NH4+数目一定小于0.3×6.02×1023
C.5.6g铁粉与硝酸反应失去的电子数一定为0.3 ×6.02×1023
D.4.5gSiO2晶体中含有的硅氧键数目为0.3×6.02×1023
第二卷:非选择题
15.下列离子方程式正确的是
A.二氧化氮溶于水:3NO2+H2O=2H++2NO3-+NO
B.将标准状况下112 mL氯气通入10 mL 1 mol·L-1的溴化亚铁溶液中: 2Fe2++4Br-+3Cl2=2Fe3++6Cl-+2Br2
C.次氯酸钙溶液中通入过量二氧化碳: Ca(ClO)2+H2O+CO2=CaCO3↓+2HClO
D.氨水和醋酸溶液混合:NH3·H2O+CH3COOH=NH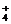 +CH3COO-+H2O
+CH3COO-+H2O
14.自然界中某些矿物的形成过程会发生如下反应:
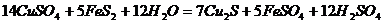 ,下列说法正确的是
,下列说法正确的是
A. FeS2只作还原剂,CuSO4只作氧化剂 B. 5mol FeS2发生反应,有21mol电子转移
C.
产物中的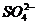 离子都是氧化产物
D. Cu2S是还原产物
离子都是氧化产物
D. Cu2S是还原产物
13.已知酸式盐NaHB在水溶液中存在下列反应:
①NaHB=Na++HB-,②HB-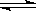 H++B2-,
H++B2-,
③HB-+H2O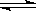 H2B+OH-,
H2B+OH-,
且溶液中c(H+)< c(OH-),则下列说法一定正确的是
A、NaHB为强电解质 B、H2B为强酸
C、Na2B溶液pH<7 D、HB-的电离程度小于HB-的水解程度
12.如图所示,杠杆AB两端分别挂有体积相同.质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧杯中央滴入M的浓溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑两球的浮力变化)
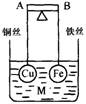 A.当M为盐酸、杠杆为导体时,A端高,B端低
A.当M为盐酸、杠杆为导体时,A端高,B端低
B.当M为CuSO4、杠杆为导体时,A端低,B端高
C.当M为CuSO4、杠杆为绝缘体时,A端低,B端高
D.当M为AgNO3、杠杆为导体时,A端高,B端低
11.在体积都为1L,pH=2的盐酸和醋酸溶液中,投入0.65g锌粒,则下图所示比较符合客观事实的是(醋酸的电离常数K=1.75×10-5)
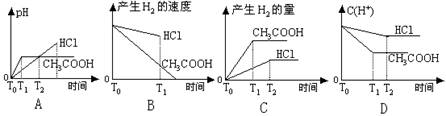
9.下表是几种物质在不同温度下的溶解度,工业上将等物质的量的NaCl、CO2、NH3溶于适量水中,在30℃时配成溶液,此时溶液无晶体,当降致某温度时,开始析出晶体。此晶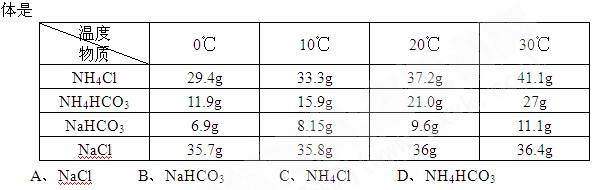 10.下列各种情况下,溶液中能大量存在的离子组是
10.下列各种情况下,溶液中能大量存在的离子组是
A.由水电离出的c(H+)=l×10-12mol/L的溶液中:K+、Ba2+、Cl-、NO3-
B.澄清透明的溶液中:I-、Cl-、ClO-、NH4+
C.使pH试纸呈红色的溶液中:K+、Fe2+、NO3-、MnO4-
D.可溶解铝粉的溶液中:K+、Mg2+、SO32-、SO42-
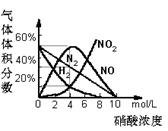
7. 某可逆反应L(s)+G(g)
某可逆反应L(s)+G(g) 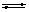 3R(g); △H>0,如图表示外界条件温度、压强的变化对上述反应的影响。试判断图中y轴不可以表示
3R(g); △H>0,如图表示外界条件温度、压强的变化对上述反应的影响。试判断图中y轴不可以表示
A.平衡混合气中R的质量分数
B.达到平衡时G的转化率
C.平衡混合气中G的质量分数
D.达到平衡时L的转化率
 C.电解NaCl水溶液可制得金属钠 D.化合物A可能是分子晶体
C.电解NaCl水溶液可制得金属钠 D.化合物A可能是分子晶体
6.室温下,等体积、都是0.5mol/L的①NaCl ②AlCl3 ③HF ④K2CO3四种物质的水溶液中,所含阳离子数目由少到多的顺序是
A.③①④② B.③①②④ C.①④③② D.④②①③
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com