
3.命题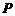 :
: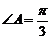 ,命题
,命题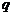 :
: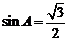 ,则
,则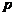 是
是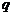 的 ( )
的 ( )
A.充分不必要条件 B.必要不充分条件
C.充要条件 D.必要不充分条件
2.若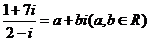 ,则乘积
,则乘积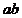 的值是
( )
的值是
( )
A.-15 B.-3 C.3 D.15
1.已知集合 ,则
,则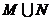 = ( )
= ( )
A.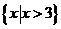 B.
B.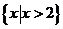 C.
C.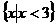 D.
D.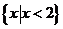
22.(8分)有50mLNaOH溶液,向其中逐渐通入一定量的CO2,随后取此溶液10mL将其稀释到100mL,并向此稀释后的溶液中逐滴加入0.1mol/L的HCl溶液,产生的CO2气体体积(标准状况下)与所加入的HCl的体积之间的关 系如图所示:试分析:
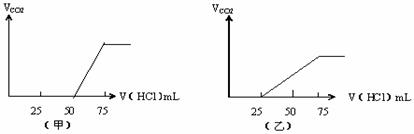
⑴NaOH在吸收CO2气体后,在甲、乙 两种情况下,所得溶液中存在的溶质是
甲: 其物质的量之比是:
乙: 其物质的量之比是:
⑵.且在两种情况下产生的CO2气体(标准状况)
各是甲: mL;乙: mL。
⑶.原NaOH溶液的物质的量浓度是 ;
21.(9分)现拟在实验室里利用空气和镁粉为原料制取少量氮化镁(Mg3N2)。已知实验中可能会发生下列反应: ①2Mg+O2 2MgO;
②3Mg+N2
2MgO;
②3Mg+N2 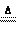 Mg3N2;
Mg3N2;
③2Mg+CO2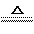 2MgO+C
④Mg+H2O
2MgO+C
④Mg+H2O MgO+H2↑
MgO+H2↑
⑤Mg3N2 +6H2O  3Mg(OH)2+2NH3↑ 可供选择的装置和药品如下图所示(镁粉、还原铁粉均已干燥,装置内所发生的反应是完全的,整套装置的末端与干燥管相连)。
3Mg(OH)2+2NH3↑ 可供选择的装置和药品如下图所示(镁粉、还原铁粉均已干燥,装置内所发生的反应是完全的,整套装置的末端与干燥管相连)。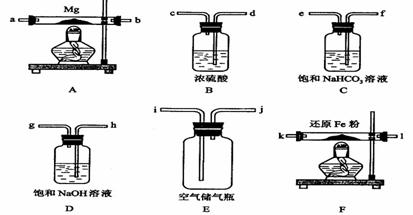
回答下列问题;
(1)在设计实验方案时,除装置A、E外,还应选择的装置(填字母代号)及其目的分别___________________________________
(2)连接并检查实验装置的气密性。实验开始时,打开自来水的开关,将空气从5升的储气瓶压入反应装置,则气流流经导管的顺序是(填字母代号)
j→_ _ ,__ _ →__ _,__ _→_ _,_ →a
(3)通气后,如果同时点燃A、F装置的酒精灯,对实验结果有何影响?__________,原因是__________ ___;
(4)请设计一个实验,验证产物是氮化镁:_____________________________ ____
20.(9分)工业炼铝是用铝土矿(主要成分是Al2O3,还有少量的Fe2O3、SiO2)提取冶炼铝的主要原料氧化铝,然后进行电解。工艺流程如下图:
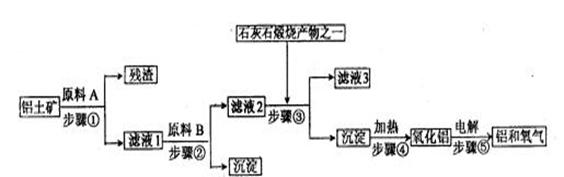
(1)滤液1中要加入稍过量的原料B,原料B的化学式是 。写出步骤②有关反应的离子方 、 。
(2)如果省去步骤①,即溶解铝土矿从直接加入原料B开始,则最终会对氧化铝的生成有什么影响? 。
(3)步骤⑤是在铝电解槽中进行,电解槽的两极材料均用石墨,其中 极的材料随反应的进行需要不断补充,为什么?
(4)铝粉与三氧化二铁粉末在引燃剂作用下常用来焊接钢轨,主要是利用了该反应 ,而且该反应焊接速度快、设备简易,适于野外作业。
19.(9分)Ⅰ. 固体氧化物燃料电池(SOFC)以固体氧化物作为
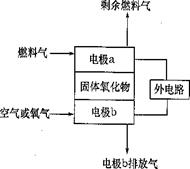 电解质介质,其工作原理如图所示。
电解质介质,其工作原理如图所示。
(1)电极b的电极反应式是
(2)假设外电路是电解硫酸铜溶液的装置。
若以C2H4为燃料气,工作一段时间后
燃料电池中消耗了标准状况下的2.24LC2H4,
则外电路阴极区的产物及其物质的量分别
是 。
Ⅱ.下列试剂均可用于除去NaCl溶液中混有
的少量Na2S。
A. CaCl2 B.AgCl C.HCl
(1)最好的试剂是 (填写序号字母)。
写出加人该试剂时反应的离子方程式 。
(2)选用另外两种试剂实验时存在缺陷,简叙其主要缺陷:
18.(10分)现有五种可溶性物质A、B、C、D、E,它们所含的阴、阳离子互不相同,分别含有五种阳离子Na+、Al3+、Mg2+、Ba2+、Fe3+和五种阴离子Cl-、OH-、NO 、CO、X中的一种。
(1)某同学通过比较分析,认为无须检验就可判断其中必有的两种物质是
和 。
(2)物质C中含有离子X。为了确定X,现将(1)中的两种物质记为A和B,当C与B的溶液混合时,产生红褐色沉淀和无色无味气体;当C与A的溶液混合时也产生沉淀,向该沉淀中滴入稀HNO3,沉淀部分溶解。则:
①X为 (填字母)。 a.Br- b.SO c.CH3COO- d.HCO
②A中含有的阴阳离子个数之比
③将0.02 mol的A与0.01 mol的C同时溶解在足量的蒸馏水中,充分反应后,最终所得沉淀的质量为 (精确到0.1 g)。
④利用上述已经确定的物质,可以检验出D、E中的阳离子。请简述实验操作步骤、现象及结论: 。
(3)将Cu投入装有D溶液的试管中,Cu不溶解;再滴加稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现。则物质D一定含有上述离子中的 (填相应的离子符号)。有关反应的离子方程式为
17.(7分) 某反应体系中的物质有:Cr2(SO4)3、K2S2O8、K2Cr2O7、K2SO4、H2SO4、H2O。
已知K2S2O8的氧化性比K2Cr2O7强。
(1)请将以上反应物与生成物编写成一个氧化还原反应方程式(不要求配平)
(2)反应中,被还原的物质是 ,Cr2(SO4)3是 。
(3)请将氧化剂与还原剂的化学式及配平后的系数填入下列空格中,并标出电子转移方向和数目:




+ +……
(4)在酸性条件下K2Cr2O7与草酸(H2C2O4)反应的产物是:Cr2(SO4)3、CO2、K2SO4和H2O,则还原剂与氧化剂物质的量之比为 。
16.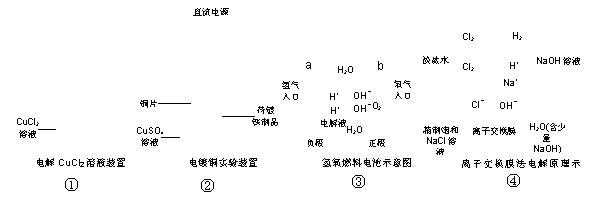 下列关于下图的说法是 ( )
下列关于下图的说法是 ( )
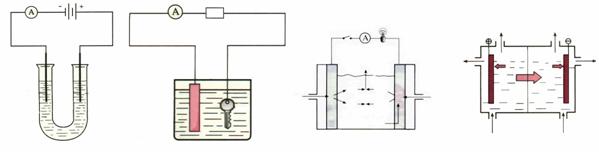
A.①装置中阴极处产生的气体能够使湿润淀粉KI试纸变蓝
B.②装置中待镀铁制品应与电源正极相连
C.③装置中电子由b极流向a极
D.④装置中的离子交换膜可以避免生成的Cl2与NaOH溶液反应
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com