
0.2-a)÷a=3:2,解得:a=0.08
A项,反应放出的热量为0.08a kJ; B项,平衡时H2O的转化率为0.08÷0.2=40%; C项,该反应前后气体系数相等,压强改变,该平衡不移动;D项, CO、H2O、CO2、H2的浓度都相等时,不一定是平衡状态。
8、(2010·临沂模拟)已知在一定条件下有CO(g)+H2O(g) CO2(g)+H2(g)在某一容积为2L的密闭容器内,加入0.2mol的CO和0.2mol的H2O,在催化剂存在的条件下,高温加热,发生如下反应:CO(g)+H2O(g)=CO2(g)+H2(g);△H=a kJ/mol反应达平衡后,测得c(CO):c(CO2)=3:2,下列说法正确的
是( )
A.反应放出的热量为0.04a kJ
B.平衡时H2O的转化率为40%
C.若将容器的体积压缩为1L,有利于该反应平衡正向移动
D.判断该反应达到平衡的依据是CO、H2O、CO2、H2的浓度都相等
[解析]选B。A项,CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
开始(mol): 0.2 0.2
反应(mol): a a a a
平衡(mol) 0.2-a 0.2-a a a
7、(2010·长沙模拟)某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g)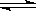 2AB3(g)化学平衡状态的影响,得到如下图所示的变化规律(图中T表示温度,n表示物质的量),根据如图可得出的判断结论正确的是( )
2AB3(g)化学平衡状态的影响,得到如下图所示的变化规律(图中T表示温度,n表示物质的量),根据如图可得出的判断结论正确的是( )

A.正反应一定是放热反应
B.达到平衡时A2的转化率大小为:b>a>c
C.正反应一定是吸热反应,且T2>T1
D.b点时,平衡体系中A、B原子数之比接近1∶3
 [答案]选D。
[答案]选D。
6、(2010·金华模拟)在一个密闭容器中用等物质的量的A和B发生反应:
A(g)+3B(g)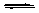 2C(g),该反应达到平衡时,平衡混和气中A的体积分数为( )
2C(g),该反应达到平衡时,平衡混和气中A的体积分数为( )
A.50% B.60% C.70% D.无法计算
[解析]选A。 A(g)+3B(g)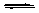 2C(g) △=2
2C(g) △=2
开始(mol): 1 1
反应(mol): a 3a 2a
平衡(mol): 1-a
混和气中A的体积分数为(1-a)÷(2- 2a)=50%
5、(2010·厦门模拟)已知某可逆反应:mA(g)+nB(g)
 xC(g),在密闭容器中进行,右图表示反应在不同时间t、温度T和压强P与C在混合气体中的百分含量(C%)的关系曲线,则正确的是( )
xC(g),在密闭容器中进行,右图表示反应在不同时间t、温度T和压强P与C在混合气体中的百分含量(C%)的关系曲线,则正确的是( )
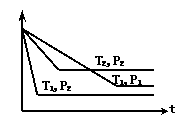
A.T1>T2 ,P1>P2 ,m+n>x ,正反应放热
B.T1<T2 ,P1<P2 ,m+n<x ,正反应吸热
C.T1>T2 ,P1<P2 ,m+n<x ,正反应放热
D.T1<T2 ,P1>P2 ,m+n>x ,正反应吸热
[解析]选C。由相同温度T1 ,不同压强下两条曲线比较知,速率快的压强大,P1<P2,由P1到P2,压强增大时,C百分含量下降,平衡逆向移动,所以,m+n<x;由相同压强T1 ,不同温度下两条曲线比较知,速率快的温度高,T1>T2,由T1到T2,温度降低时,C百分含量升高,平衡正向移动,所以,正反应放热。
4、(2010·延边模拟)高温下,某反应达到平衡,平衡常数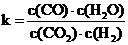 ,恒容时,温度升高,H2
,恒容时,温度升高,H2
浓度减小,下列说法正确的是( )
A.该反应的焓变为正值
B.恒温恒容下,增大压强,H2浓度一定减小
C.升高温度,逆反应速率减小

D.该反应化学方程式为CO+H2O CO2+H2

[解析]选A。由平衡常数的表达式知,该反应化学方程式为CO2+H2 CO+H2O,D错;
项。A项,温度升高,H2浓度减小,说明平衡正向移动,该反应为吸热反应,焓变为正值;B项,恒温恒容下,增大压强,相当于体积缩小,H2浓度一定增大;C项,升高温度,正、逆反应速率都会增大。
3、(2010·哈尔滨模拟)设反应① △H=akJ/mol,反应
△H=akJ/mol,反应
② △H=bkJ/mol,以上两反应的平衡常数分别为K1和K2。在不同温度下,K1、K2的值如下:
△H=bkJ/mol,以上两反应的平衡常数分别为K1和K2。在不同温度下,K1、K2的值如下:
|
T/K |
K1 |
K2 |
|
973 |
1.47 |
2.38 |
|
1173 |
2.15 |
1.67 |
下列有关叙述正确的是( )
A.b>0 B.在973K下增大压强,K2增大
C.a>b D.在常温下反应①一定能自发进行
[解析]选C。平衡常数只与温度有关,温度不变时,增大压强,K2不变;对于反应①能否自发进行,要看△H- T△S的值。
2、(2010·南京模拟)在500℃,恒容的密闭容器中合成氨,起始充入氮气和氢气共a mol,平衡时容器内压强为起始时的75%;若起始充入氮气、氢气和氨气的混合气体共a mol,测得平衡时压强仍为起始时的75%,则两次平衡体系中氨气的百分含量的关系是( )
A.前者 > 后者 B.前者 < 后者 C.两者相等 D.无法确定
[解析]选B。起始充入氮气、氢气和氨气的混合气体共a mol,相当于充入氮气、氢气的物质的量的和多于a mol,合成氨反应正向气体化学计量数减少,而两种情况平衡时压强相同,所以,后者相当于平衡正向移动,氨气的百分含量后者大。
1、(2010·济南模拟)在一恒容密闭容器中通入A、B两种气体,在一定条件下发生反应:
2A(g)+B(g)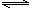 2C(g);△H<0。当达到平衡后,保持其他条件不变,只改变条件X,则相应量Y的改变一定符合图中曲线的是( )
2C(g);△H<0。当达到平衡后,保持其他条件不变,只改变条件X,则相应量Y的改变一定符合图中曲线的是( )
|
|
X |
Y |
|
A |
温度 |
C的体积分数 |
|
B |
充入稀有气体 |
A的物质的量 |
|
C |
再加入A |
B的转化率 |
|
D |
再加入C |
A的百分含量 |
[解析]选C。A项,该反应是放热反应,温度升高时化学平衡逆向移动,C的体积分数下降,与图不符合;B项,恒容密闭容器中充入稀有气体,平衡不移动,A的物质的量不变,不符合;C项,再加入A,平衡正向移动,B的转化率增大,符合;D项,再加入C,相当于压强增大,平衡正向移动,A的百分含量减少。
1 ?球O1、O2、分别与正方体的各面、各条棱相切,正方体的各顶点都在球O3的表面上,求三个球的表面积之比.
?球O1、O2、分别与正方体的各面、各条棱相切,正方体的各顶点都在球O3的表面上,求三个球的表面积之比.
分析:球的表面积之比事实上就是半径之比的平方,故只需找到球半径之间的关系即可.
解:设正方体棱长为a,则三个球的半径依次为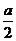 、
、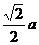 ,
,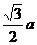
∴ 三个球的表面积之比是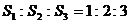 .
.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com