
17、(2010·天津和平区模拟)氮化硅是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
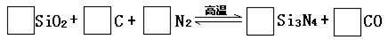
⑴配平上述反应的化学方程式(将化学计量数填在方框内)
⑵该反应中的氧化剂是 ,其还原产物是 ;
⑶该反应的平衡常数表达式为K= ;
⑷若知上述反应为放热反应,则其反应热为ΔH 零(填“大于”、“小于”或“等于”);升高温度,其平衡常数值 (填“增大”、“减小”或“不变”)
⑸若使压强增大,则上述平衡向 反应方向移动(填“正”或“逆”);
⑹若已知CO生成速率为v(CO)=18mol/(L•min)则N2的消耗速率为v(N2)= mol/(L•min)。
[解析]本题是一道主要考查化学反应速率和化学平衡的综合题。
(1)用化合价升降法配平3SiO2+6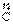 +2
+2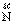 2
2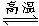 Si3N4+6CO
Si3N4+6CO
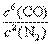 (2)N2为氧化剂,C为还原剂,Si3N4为还原产物。
(2)N2为氧化剂,C为还原剂,Si3N4为还原产物。
(3)因为N2、CO为气体,K= ;
(4)反应热用ΔH来表示,ΔH<0,升高温度,平衡向吸热方向移动,即向逆反应方向移动,K减小。
(5)增大压强, 平衡向气体体积减小的方向移动,即向逆反应方向移动。
(6)速率之比等于化学计量数之比,则N2消耗速率为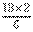 mol·(L·min)-1=6 mol·(L·min)-1。
mol·(L·min)-1=6 mol·(L·min)-1。
[答案](1)3 6 2 1 6 (2)N2 (3)Si3N4 (4)小于 减小 (5)逆 (6) 6
16、(2010·海南琼海模拟)在一体积为1L的密闭容器中发生反应:2HI(g)
 H2(g) + I2(g) ,当HI气体的起始浓度为1mol/L,H2和I2气体的起始浓度为0时,出现如下可能的图像
H2(g) + I2(g) ,当HI气体的起始浓度为1mol/L,H2和I2气体的起始浓度为0时,出现如下可能的图像
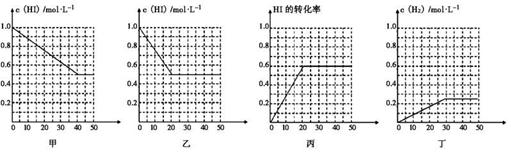
下列有关说法正确的是( )
A、甲、乙中的反应温度不同,压强相同
B、甲中可能未使用催化剂,乙中可能使用了催化剂
C、丙中的平衡混合物中,物质H2的浓度等于0.6mol/L
D、丁和乙比较,丁中可能增大了反应体系的压强
[答案]选B。
15、(2010·北京首都学院附中模拟)在一定条件下,反应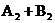
 2AB;△H = Q kJ/mol 的反应时间与生成物AB的质量分数(AB%)的关系如图所示,其中a为500℃,b为300℃时的情况(其他条件不变),c则为在时刻
2AB;△H = Q kJ/mol 的反应时间与生成物AB的质量分数(AB%)的关系如图所示,其中a为500℃,b为300℃时的情况(其他条件不变),c则为在时刻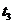 开始缩小容器容积(温度维持300℃)的情况,则( )
开始缩小容器容积(温度维持300℃)的情况,则( )
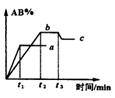
A.AB可能为气体 B.A2与B2都为气体 C.Q >0 D. Q <0
[答案]选D。
14、(2010·佛山模拟)2SO2(g)+O2(g) 2SO3(g) △H<0 是制备硫酸的重要反应。下列叙述正确的
2SO3(g) △H<0 是制备硫酸的重要反应。下列叙述正确的
是( )
A.选用有效的催化剂能增大正反应速率并提高SO2的转化率
B.增大反应体系的压强,反应速率不一定增大。
C.该反应是放热反应,降低温度将缩短反应达到平衡的时间
D.在t1、t2时刻,SO3(g)的浓度分别是c1,c2,则时间间隔t1-t2内,则SO3(g)生成的平均速率为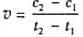
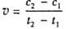 [解析]选D。A项,选用有效的催化剂能增大正反应速率,但是不能改变SO2的转化率;B项,增大反应体系的压强,反应物浓度不一定增大,所以反应速率不一定增大;C项,该反应是放热反应,降低温度会使平衡正向移动,但是反应速率降低,反应达到平衡的时间将变长;D项,在t1、t2时刻,SO3(g)的浓度分别是c1,c2,则时间间隔t1-t2内,则SO3(g)生成的平均速率为
。
[解析]选D。A项,选用有效的催化剂能增大正反应速率,但是不能改变SO2的转化率;B项,增大反应体系的压强,反应物浓度不一定增大,所以反应速率不一定增大;C项,该反应是放热反应,降低温度会使平衡正向移动,但是反应速率降低,反应达到平衡的时间将变长;D项,在t1、t2时刻,SO3(g)的浓度分别是c1,c2,则时间间隔t1-t2内,则SO3(g)生成的平均速率为
。
13、(2010·六安模拟)对已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,下列有关叙述正确的是( )
①生成物的百分含量一定增加 ②生成物的产量一定增加 ③反应物的转化率一定增大
④反应物的浓度一定降低 ⑤正反应速率一定大于逆反应速率 ⑥使用了适宜的催化剂
A.②⑤ B.①② C.③⑤ D.④⑥
[解析]选A。减少生成物的量使化学平衡向正反应方向移动时,正反应速率一定大于逆反应速率,生成物的百分含量减小,生成物的产量增加,反应物的转化率增大,反应物的浓度一定降低;当增大反应物浓度使化学平衡向正反应方向移动时,正反应速率一定大于逆反应速率,生成物的产量增加,反应物的转化率降低,反应物的浓度增大。
12、(2010·广州模拟)各可逆反应达平衡后,改变反应条件,其变化趋势正确的是( )
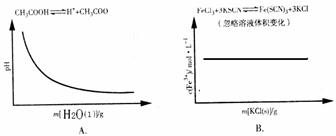
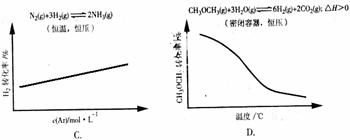
[解析]选B。A项,相当于将醋酸稀释,醋酸的电离程度增大,但是电离出的C(H+)减小,溶液的pH增大;B项,增加KCl的量对平衡无影响;C项,恒温、恒压下充入惰性气体,相当于减小物质浓度,结合化学方程式可知,浓度积大于平衡常数,所以平衡逆向移动,H2的转化率减小;D项,密闭容器中,恒压条件下升高温度,平衡向吸热方向移动,即向正反应方向移动,CH3O CH3的转化率增大。
0.3 mol·L-1,则vb=0.075 mol·L-1·s-1,故B项正确;平衡后,增大压强平衡正移,A的转化率增大,故C项错误;平衡后,升温平衡逆移,C的浓度减小,故D项错误。
11(2010·潍坊模拟)关于下列各图的叙述正确的是( )
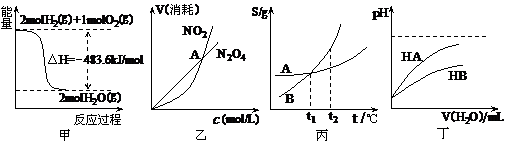

A.甲表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为483.6kJ·mol-1
B.乙表示恒温恒容条件下发生的可逆反应2NO2(g) N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
C.丙表示A、B两物质的溶解度随温度变化情况,将A、B饱和溶液分别由T1℃升温至T2℃时,溶质的质量分数B>A
D.丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则同浓度的NaA溶液的pH小于NaB溶液
[答案]选D。
10、(2010·连云港模拟)将 4 mol A 气体和 2 mol B 气体在 2 L
的密闭容器中混合并在一定条件下发生如下反应 2A(g)+B(g)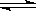 2C(g);△H <0。4 s(秒)后反应达到平衡状态,此时测得 C 的浓度为0.6 mol·L-1 。下列说法中正确的是 ( )
2C(g);△H <0。4 s(秒)后反应达到平衡状态,此时测得 C 的浓度为0.6 mol·L-1 。下列说法中正确的是 ( )
A.当A 、B、C物质的量浓度之比为 2:1:2时,反应即达到平衡状态
B.4s内用物质B表示的反应速率为0.075 mol·L-1·s-1
C.达平衡后若通入一定量氦气,A的转化率降低
D.达平衡后若升高温度,C的浓度将增大
[解析]选B。各物质浓度是否满足方程式计量数比,与反应是否平衡无关,故A项错;4 s内消耗c(B)=
0.075 mol·L-1;则下列关于C物质状态的推测正确的是( )
①C为非气态;②C为气态;③第二次达到平衡时C为气态;④第三次达到平衡时C为非气态A.② B.③④ C.②④ D.①④
[解析]选C.第一次平衡与第二次平衡相比,c(A)增加的浓度大于压强的增加,故增压时平衡向逆反应方向移动,从而可确定第二次达到平衡时C为气态;第二次平衡与第三次平衡相比,c(A)浓度的增加程度小于压强的增加程度,故增压平衡向正反应方向移动,从而确定第三次达到平衡时C为非气态,故选C项。
9、(2010·合肥模拟)温度为T℃,压强为1.01×106Pa条件下,某密闭容器下列反应达到化学平衡A(g)+ B(g)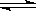 3C(?),测得此时c(A)=0.022 mol·L-1;压缩容器使压强增大到2.02×106Pa,第二次达到平衡时,测得c(A)=0.05 mol·L-1;若继续压缩容器,使压强增大到4.04×107Pa,第三次达到平衡时,测得c(A)=
3C(?),测得此时c(A)=0.022 mol·L-1;压缩容器使压强增大到2.02×106Pa,第二次达到平衡时,测得c(A)=0.05 mol·L-1;若继续压缩容器,使压强增大到4.04×107Pa,第三次达到平衡时,测得c(A)=
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com