
21. (2010·临沂模拟)由几种离子化合物组成的混合物,含有以下离子中的若干种:K+、Cl-、NH、Mg2+、CO、Ba2+、SO.将该混合物溶于水后得澄清溶液,现取3份100 mL该溶液分别进行如下实验:
|
实验 序号 |
实验内容 |
实验结果 |
|
1 |
加AgNO3溶液 |
有白色沉淀生成 |
|
2 |
加足量NaOH溶液并加热 |
收集到气体1.12 L(已折算成标准状况下的体积) |
|
3 |
加足量BaCl2溶液时,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 |
第一次称量读数为6.27 g,第二次称量读数为2.33 g |
试回答下列问题:
(1)根据实验1对Cl-是否存在的判断是____________(填“一定存在”“一定不存在”或“不能确定”);根据实验1-3判断混合物中一定不存在的离子是________.
(2)试确定溶液中一定存在的阴离子及其物质的量浓度(可不填满):
|
阴离子符号 |
物质的量浓度(mol/L) |
|
|
|
|
|
|
|
|
|
(3)试确定K+是否存在?________,判断的理由是________________________________
______________________________________________________________.
20.常温下,将20.0 g 14%的NaCl溶液跟30.0 g 24%的NaCl溶液混合,得到密度为1.17 g/cm3的混合溶液.
(1)该混合溶液中NaCl的质量分数为 .
(2)该混合溶液中NaCl的物质的量浓度 mol/L.
(3)在1000 g水中需加入 mol氯化钠,才能使其浓度恰好与上述混合溶液浓度相等(保留1位小数).
19. 某研究性学习小组为证明在同温同压下,相同浓度、
某研究性学习小组为证明在同温同压下,相同浓度、
相同体积酸性不同的两种二元酸与足量镁带反应时,生成氢气
的体积相同而反应速率不同,同时测定实验室条件下的气体摩
尔体积.设计的简易实验装置如图所示.该实验的主要操作步骤
如下:
Ⅰ.①配制浓度均为0.5 mol/L 的H2SO4和H2C2O4溶液.
②用 量取10.00 mL 0.5 mol/L H2SO4和H2C2O4溶液分别于两个锥形瓶中.
③分别称取除去表面氧化膜的镁带并系于铜丝末端.
④检查装置的气密性,在广口瓶中装满水,按图连接好装置.
⑤将铜丝向下移动,使足量镁带浸入酸中(铜丝不与酸接触)至反应完全后,记录 .
⑥反应结束后,读取量筒内水的体积为 y mL.
Ⅱ.请将上述步骤补充完整并回答下列问题:
(1)用密度为1.84 g/cm3 98%的浓H2SO4,配制浓度为250 mL 0.5 mol/L的H2SO4溶液,所需要的主要仪器有 、 、烧杯、玻璃棒、酸式滴定管.
(2)以下是读取量筒内水的体积时,必须包括的几个步骤:①使乙、丙中液面相平;②将装置冷却至室温;③读取量筒内水的体积.这三步操作的正确顺序是 .
(3)读取量筒内水的体积时,若丙中液面高于乙中液面,使乙、丙中液面相平的操作是 .
(4)简述速率不等的原因 ,铜丝不与酸接触的原因 .
18. (2009·厦门模拟)“探险队员”--盐酸,不小心走进了化学迷宫,不知怎样走出来,因为迷宫有许多“吃人的野兽”(即能与盐酸反应的物质或水溶液),盐酸必须避开它们,否则就无法通过.

(1)请你帮助它走出迷宫(请用图中物质前的序号连接起来表示所走的路线)________________.
(2)在能“吃掉”盐酸的化学反应中,属于酸和碱中和反应的有__________个,属于氧化还原反应的有__________个,其中能“吃掉”盐酸的盐是__________,写出该反应的离子方程式________________________________________________.
(3)在不能与盐酸反应的物质中,属于电解质的是__________(填写物质序号),属于非电解质的是________.
(4)如果将盐酸换成氯气,它能沿着盐酸走出的路线“走出”这个迷宫吗?为什么?
______________________________________________________________________.
17、下图是几种盐的溶解度曲线,下列说法中正确的是

A.40℃时,将35 g食盐溶于100 g水中,降温至0℃时,可析出NaCl晶体
B.20℃时KNO3饱和溶液的溶质质量分数为31.6%
C.60℃时,200 g水中溶解80 g CuSO4达饱和,当降温至30℃时,可析出30 g硫酸铜晶体
D.30℃时,将35 g KNO3和35 g NaCl同时溶于100 g水中,蒸发时先析出的晶体是NaCl
16.(2010四川理综卷,12)标准状况下VL氨气溶解在1L水中(水的密度近似为1g/ml),所得溶液的密度为p g/ml,质量分数为ω,物质浓度为c mol/L,则下列关系中不正确的是 ( )
A.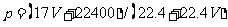 B.
B. 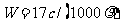
C.  D.C=1000Vρ/(17V+22400)
D.C=1000Vρ/(17V+22400)
15.已知32gX和40gY恰好完全反应,生成mgQ和9gH,在相同条件下,16gX和30gY混合反应生成0.25molQ及若干摩尔H,则物质Q的摩尔质量应是( )
A.163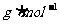 B.126
B.126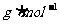 C.122
C.122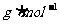 D.63
D.63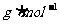
14.在标准状况下,称量一个充满氯气的容器质量为74.6克,若改充氮气,其质量为66克,则容器的容积为( )
A、11.2L B、5.6L C、4.48L D、2.24L
13.某学生配制了100 mL 1 mol/L的硫酸溶液.然后,对溶液浓度做精确测定,且测定过程中一切操
作都正确.结果测得溶液的物质的量浓度低于1 mol/L.那么,在配制过程中,下列操作可能导致溶液
浓度偏低的是 ( )
①量筒用蒸馏水洗净后立即用来量取浓硫酸
②将浓硫酸在烧杯中稀释,转移到容积为100 mL的容量瓶中后,没有洗涤烧杯
③在转移过程中用玻璃棒引流,因操作不慎有少量溶液流到了容量瓶外面
④最后定容时,加水超过了刻度,马上用胶头滴管吸去多余的水,使溶液凹液面刚好与刻度线相切
A.②③④ B.③④ C.①②③ D.①②③④
12.用某种仪器量取液体体积时,平视时读数为n mL,仰视时读数为 x mL,俯视时读数为y mL,若x>n>y,则所用的仪器可能为 ( )
A.量筒 B.容量瓶 C.滴定管 D.以上均不对
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com