
3.函数极限的定义:
(1)当自变量x取正值并且无限增大时,如果函数f(x)无限趋近于一个常数a,就说当x趋向于正无穷大时,函数f(x)的极限是a.
记作: f(x)=a,或者当x→+∞时,f(x)→a.
f(x)=a,或者当x→+∞时,f(x)→a.
(2)当自变量x取负值并且绝对值无限增大时,如果函数f(x)无限趋近于一个常数a,就说当x趋向于负无穷大时,函数f(x)的极限是a.
记作 f(x)=a或者当x→-∞时,f(x)→a.
f(x)=a或者当x→-∞时,f(x)→a.
(3)如果 f(x)=a且
f(x)=a且 f(x)=a,那么就说当x趋向于无穷大时,函数f(x)的极限是a,记作:
f(x)=a,那么就说当x趋向于无穷大时,函数f(x)的极限是a,记作: f(x)=a或者当x→∞时,f(x)→a.
f(x)=a或者当x→∞时,f(x)→a.
2.几个重要极限:
(1) (2)
(2) (C是常数)
(C是常数)
(3)无穷等比数列 (
( )的极限是0,即
)的极限是0,即 

1.数列极限的定义:
一般地,如果当项数 无限增大时,无穷数列
无限增大时,无穷数列 的项
的项 无限趋近于某个常数
无限趋近于某个常数 ,那么就说数列
,那么就说数列 以
以 为极限.记作
为极限.记作 .
.
30、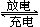 (2010·广州模拟)LiFePO4电池具有稳定性高、安全、对环境友好等优点,可用于电动汽车。电池反应为FePO4+Li
LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨和锂,含Li+ 导 电固体为电解质。
(2010·广州模拟)LiFePO4电池具有稳定性高、安全、对环境友好等优点,可用于电动汽车。电池反应为FePO4+Li
LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨和锂,含Li+ 导 电固体为电解质。
下列有关LiFePO4电池说法正确的是( )
A.可加入硫酸以提高电解质的导电性
B.充电过程中,电池正极材料LiFePO4的质量减少
C.放电时电池内部Li+ 向负极移动
D.放电时电池负极反应为:FePO4+Li++e- = LiFePO4
[解析]选B。A项,Li可与硫酸反应,不能加入硫酸以提高电解质的导电性;B项,电池的正极材料是LiFePO4,充电时,LiFePO4被氧化成FePO4质量减少;C项,放电时电池内部Li+ 向正极移动;D项,放电时电池负极发生氧化反应:Li- e-= Li+
()
29、(2010·大连模拟)一种新型环保电池是采用低毒的铝合金(丢弃的易拉罐),家庭常用的漂白水,食盐,氢氧化钠(化学药品店常见试剂)等原料制作的。电池的总反应方程式为2A1+3ClO-+2OH-==== 3C1-+2AlO-2+H2O。下列说法不正确的是 ( )
A.该电池的优点是电极材料和电解质用完后可以更换
B.该电池发生氧化反应的是金属铝
C.电极的正极反应式为3ClO-+3H2O+6e-====3Cl-+6OH-
D.当有0.1mol Al完全溶解时,流经电解液的电子个数为1.806×1023
[解析]选D。D项,电子只能流经导线,不能流经电解液。
28、(2010·南京模拟)用铅蓄电池电解苦卤水 (含C1―、Br―、Na+、Mg2+)的装置如图所示 (a、b为石墨电极)。
下列说法中正确的是
A.铅蓄电池放电时,该电池两极质量均增加
B.铅蓄电池充电时,A极应与外电源负极相连
C. 电解苦卤水时,a 电极首先放电的是Br―而不是Cl―,说明当其它条件相同时Br―的还原性强于Cl―
D.当b极产生0.01mol 气体时,铅蓄电池中消耗0.01 mol H2SO4
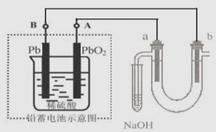
[解析]选C。A项,B项,铅蓄电池充电时PbO2极发生氧化反应,所以A极应与外电源正极相连;C项,电解时,还原性强的阴离子先被氧化;D项,b极产生的0.01mol 气体为H2,转移0.02mol电子,消耗0.02 mol H2SO4.
27、(2010·广州模拟)下列说法正确的是( )
A.铅蓄电池放电时铅电极发生还原反应
B.电解饱和食盐水在阳极得到氯气,阴极得到金属钠
C.给铁钉镀铜可采用CuSO4 作电镀液
D.生铁浸泡在食盐水中发生析氢腐蚀
[解析]选C。A项,铅蓄电池放电时铅电极发生氧化反应生成二氧化铅;B项,电解饱和食盐水在阳极得到氯气,阴极得到氢气;C项,镀铜可用含Cu2+的电解质溶液 作电镀液;D项,生铁浸泡在食盐水中发生吸氧腐蚀。
26、(2010·重庆模拟)U、V、W、X、Y、Z属于周期表中前18号元素,原子序数依次增大。已知:
①WU4++XU-=WU3 + U2X,各种反应物和生成物的电子总数都与Y+相等;
②Z的单质在X2中燃烧的产物可使品红溶液褪色;
③V的单质在X2中燃烧可生成VX和VX2两种气体;
④Y的单质是一种金属,该金属与X2反应可生成Y2X和Y2X2两种固体。
请回答下列问题:
(1)W与X的氢化物分子结合氢离子的能力较强的是 ,方程式表示 。
(2)V、W、X形成的10电子氢化物中,沸点最高的是(写化学式) 。
(3)U2X2与FeSO4按物质的量之比1:2溶于稀硫酸中,离子方程式为________
(4)已知下图的球棍模型所表示的是由U、W两种元素组成的共价化合物A,
则A的分子式为 。A与氧气及氢氧化钾溶液还可构成燃料电池,电池正极的电极反应为:

[解析]根据①,反应为NH4++OH-=NH3+H2O,所以可以推测,U为H元素,W为N元素,X为O元素,Y为Na元素;根据②,Z为S元素;根据③,V为C元素。
[答案](1)NH3,NH3+H2O
 NH3·H2O
NH3·H2O
 NH4++OH-
NH4++OH-
(2) H2O
(3)H2O2+2Fe2++2H+=2Fe3++2H2O
(4)N2H4,O2+4e-+2H2O=4OH-
25、(2010·重庆模拟)有A、B、C、D、E、五种常见的短周期元素,它们的原子序数依次增大,其中C元素原子最外层电子数是次外层电子数的3倍,B元素原子的最外层电子数比C元素原子的最外层电子数少1个;A和D,C和E同主族,又知C、E两原子序数之和是A、D两原子序数之和的2倍。请回答下列问题:
(1)写出由A、C、D三种元素形成的化合物的电子式。
( 2)B的氢化物的沸点比同主族其他氢化物的沸点高,这可用_____来解释。
A、极性分子 B、氢键 C、共价键 D、离子键
(3)D2E溶液呈 (填“碱性”、“酸性”、“中性”),原因是 。
(4)1L0.1 mol/LD的最高价氧化物的水化物与1L0.1 mol/LE的最高价氧化物的水化物反应放出5.73kJ的热量,该反应的热化学方程式为: 。
(5)由B的氢化物与C的单质、 KOH溶液构成原电池,负极产生B的单质。则其负极电极反应方程式为 。
[解析]根据题意,C元素为O元素,所以E为S元素,B元素为N元素;又因为C、E两原子序数之和是A、
D两原子序数之和的2倍,所以A为H元素,D为Na元素。
[答案](1)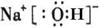
(2)B
(3)碱性 S2- +
H2O HS- + OH-
HS- + OH-
(4)2NaOH(aq) 十H2 SO4 (aq) (g)=Na2SO4 (aq)+2H2O(l);△H=-114.6kJ/mol
(5)2NH3-6e-+ 6OH- =N2+6H2O
24、(2010·琼海模拟)将三份锌粉分别装入甲乙丙三支试管中,向甲试管加入50mL pH=3的盐酸,向乙试管加入50mLpH=3的醋酸溶液,向丙试管依次加入50mLpH=3的醋酸溶液和少量的无水硫酸铜粉末,反应结束后产生的H2体积在相同条件下一样多且无锌粉剩余。请回答下列问题(用“<”、“ >”、“ =”表示大小关系)
(1)开始反应时,甲乙丙速率大小关系为
(2)反应过程中,丙比乙速率快的原因是
(3)反应结束时甲乙丙所需时间关系为
(4)三支试管中参加反应的锌的质量关系是
[解析](1)反应开始时,三支试管中PH均为3,即[H+]相同,所以反应速率相同。
(2)因为丙中有硫酸铜,锌置换出单质铜,形成原电池,加快了锌粉的反应速率
(3)反应开始后,甲中[H+]就会小于乙,而丙中又形成原电池,所以反应速率丙>乙>甲
(4)生成氢气体积相同,丙中锌粉一部分与硫酸铜发生反应,所以丙中锌粉最多,甲乙中锌粉相同
[答案](1) v(甲)= v(乙)= v(丙)
(2)丙中构成了原电池,速率加快
(3) 甲>乙>丙
(4)甲=乙<丙
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com