
1、自由落体运动是初速度为零的匀加速直线运动。
教材详解
3、小羽毛的重心位置(梗部位)粘上小细铁片、使其下落时不旋转。
2、将软木塞的一端用小铁片粘住;
1、小铅块换成小铁块;
9]硫酸铵是农村常用的一种铵态氮肥。试回答下列问题:
⑴某硫酸铵肥料,实验测得氮的质量分数为20%,这种样品中可能混有( )。
A.碳酸氢铵 B.硝酸铵 C.氯化铵 D.磷酸氢二铵
⑵下列物质不能跟硫酸铵肥料混合施用的是( )。
A.碳酸氢铵 B.草木灰 C.过磷酸钙 D.氯化钾
⑶田间一次施用化肥过多会使植物变得枯萎发黄,俗称“烧苗”,其原因是( )。
A.根细胞从土壤中吸收的养分过多 B.根细胞不能从土壤中吸水
C.根系不能将水向上运输 D.根系加速了呼吸作用,释放的能量过多
[命题解读]《考试说明》要求“了解化学肥料、农药等在农业生产中的作用。”本题以最常见的氮肥硫酸铵为材料考查了学生对化肥知识的掌握情况。涉及到了计算、化肥的施用过程中易出现的问题等多方面的知识。对学生综合应用知识的能力要求很高。这一类题一般难度不大,往往以生活常识为背景,有新意。
[解题指导]⑴硫酸铵含氮量为21.2%>20%,则必定含有含氮量比20%小的一种化肥,经计算只有NH4HCO3含氮量低于20%。
⑵硫酸铵为铵态氮肥,这种肥料不能跟碱性物质混合使用,因易产生挥发物质氨气,降低肥效,而草木灰的主要成分是K2CO3,水解显碱性。
⑶当使用化肥过多时,根细胞不能从土壤中吸水而发黄。
答案:⑴A ⑵B ⑶B
8]硫酸工业中,如何有效吸收尾气里的二氧化硫、防止空气污染一直是化学家们研究的课题。从理论上讲,可以吸收二氧化硫的试剂很多,但实际上采用时要考虑许多因素,诸如原料成本、动力消耗、吸收效率、是否具有二次污染、能否取得有价值的副产品等等,因此在尾气处理中应设法进行综合利用。
⑴为了降低硫氧化物造成的污染,一种方法是在含硫燃料中(如煤)加入生石灰,这种方法称作“钙基固硫”,这种方法中“固硫”的反应是( )。
A.2CaO+2S=2CaS+O2↑ B.S+O2=SO2
C.CaO+SO2=CaSO3 D.2CaSO3+O2=2CaSO4
⑵近闻美国和日本正在研究有Na2SO3作为治理SO2污染的一种新方法,第一步是用Na2SO3溶液吸收SO2;第二步是加热吸收液,使之重新生成Na2SO3,同时得到含高浓度SO2的水蒸气副产品,试写出上述两步反应的化学方程式
⑶我国化学家先后试用了烧碱吸收法、纯碱吸收法、石灰吸收法和氨水吸收法,根据我国的国情,现在一般采用氨水吸收法,写出用氨水吸收过量二氧化硫的化学方程式
⑷某硫酸厂每天排放1000m3(已换算成标准状况下体积)尾气中含0.2%(体积分数)的SO2,假设硫元素不损失,若用NaOH溶液、石灰及氧气处理后,理论上可得到多少kg石膏(CaSO4·2H2O)?
[命题解读]化学污染问题与化学技术的知识联系非常密切,以污染为背景的命题往往涉及到反应的原理、污染的危害、实验、计算等多项知识。一般难度适中,但对能力的要求比较高。
[解题指导](1)硫燃烧产生SO2,加入生石灰的目的是除去SO2,因此应选择C,再者生成的CaSO3易被氧化,所以还应选择D。(2)本反应类似于二氧化碳与碳酸盐反应,生成了酸式盐,弱酸的酸式盐一般不稳定,受热易分解。(3)类似于第(2)小题。
答案:⑴CD ⑵Na2SO3+SO2+H2O=2NaHSO3 2NaHSO3  Na2SO3+SO2↑+H2O
Na2SO3+SO2↑+H2O
⑶SO2+2NH3·H2O=(NH4)2SO3+H2O (NH4)2SO3+H2O+SO2=2NH4HSO3 ⑷15.36kg
7]在饱和食盐水中先通入氨气进行氨化,再通入二氧化碳,可制得小苏打。在析出小苏打晶体滤掉的母液中加入生石灰,可将氨气回收利用。小苏打在2500C下焙烧可得纯碱,分解所得二氧化碳也可以回收利用。以上所述称为索尔维制碱法。
⑴饱和食盐水先氨化,再通CO2的原因是
反应的化学方程式是 。
⑵在析出小苏打的母液中加入生石灰以回收氨气的化学方程式是 。
⑶我国著名化学家侯德榜在析出小苏打的母液里在一定条件下加入NaCl粉末,使母液中的NH4Cl结晶析出,可生产化肥NH4Cl。在析出NH4Cl的母液中再通入氨气氨化,又可通CO2制取小苏打。创立了举世闻名的“侯氏制碱法”。简答侯氏制碱法的主要优点。
[命题解读]制碱工业是一项既重要又成熟的工业,而且产物纯碱与我们的生活密切相关,因此在化学技术教材中对这一部分内容进行了全面的介绍.这一部分内容考查的形式主要是理解生产过程,可涉及到实验、计算等多项知识。一般难度适中。
[解题指导]在食盐溶液中通入氨得到NaCl与氨水的混合溶液,此时NaCl和NH3的浓度均达到很浓的程度,再通入CO2,则氨水大量吸收CO2生成浓度更大的NH4HCO3溶液。这时发生NH4HCO3与NaCl的反应,因NaHCO3此时溶解度比NH4Cl、NH4HCO3、NaCl都小而结晶析出。反之先通入CO2则CO2以1﹕1溶于水,再通氨气,得不到浓NH4HCO3溶液,而不能析出NaHCO3晶体,不能滤出NaHCO3去加热制Na2CO3。按反应:
2NaHCO3  Na2CO3+CO2↑+H2O,有一半的CO2可以回收利用。上述母液中加CaO后生成Ca(OH)2与NH4Cl反应生成NH3得以全部(理论上)回收利用。但反应生成的CaCl2无多大用途,成为废渣难于处理。侯氏制碱法可多得到一种产品NH4Cl,将NaCl中Cl-也充分利用,且无废料CaCl2,并少用原料CaO。
Na2CO3+CO2↑+H2O,有一半的CO2可以回收利用。上述母液中加CaO后生成Ca(OH)2与NH4Cl反应生成NH3得以全部(理论上)回收利用。但反应生成的CaCl2无多大用途,成为废渣难于处理。侯氏制碱法可多得到一种产品NH4Cl,将NaCl中Cl-也充分利用,且无废料CaCl2,并少用原料CaO。
答案:⑴ 使溶液中NH4HCO3形成浓溶液,便于与NaCl生成小苏打。
NH3+H2O+CO2=NH4HCO3 NH4HCO3+NaCl=NH4Cl+NaHCO3↓(浓溶液中)
 ⑵ 2NH4Cl+CaO CaCl2+NH3↑+H2O
⑵ 2NH4Cl+CaO CaCl2+NH3↑+H2O
⑶ ①使NaCl中的Cl-也以利用,②减少了原料CaO,不再生产废渣CaCl2,增加了新产品氯化铵,既免于废渣CaCl2对环境的污染,又使各原料得到充分利用。
6]利用天然气气合成氨的工艺流程示意如下:
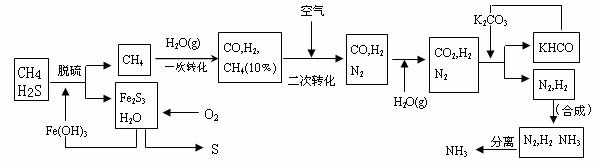
根据上述流程,完成下列填空:
⑴ 天然气脱硫时的化学方程式是 。
⑵ n molCH4经一次转化后产生CO mol、生产H2 mol(用含n的代数式表示)。
⑶ K2CO3(aq)和CO2反应在加压下进行,加压的理论依据是 。
A.相似相溶原理 B.勒夏特列原理 C.酸碱中和原理
⑷ 整个流程有三处循环,一是Fe(OH)3循环,二是K2CO3(aq)循环,请在上述流程图中标出第三处循环(循环方向、循环物质)。
[命题解读]《考试说明》要求“了解合成氨的主要原理、原料、重要设备、流程和意义,认识催化剂的研制对促进化学工业发展的重大意义”本题以利用天然气合成氨的过程为背景知识,对学生“接受、吸收、整合化学信息的能力,分析问题和解决问题的能力”进行了全面的考查。而对于有关流程图的习题往往对学生的逻辑推理能力要求较高。
[解题指导](1)从图可以看出H2S与Fe(OH)3发生了反应,产物为Fe2S3和水,即可得化学方程式。(2)由CH4+H2O=CO+3H2可知1molCH4可生成3molH2。从图中可知,CH4的转化率为90%,所以可得n molCH4经一次转化后产生COnmol,生产H22.7mol(3)因为是化学平衡的移动,所以用勒夏特列原理来解释.(4)循环如图.
答案:⑴3H2S+2Fe(OH)3=Fe2S3+6H2O
⑵ n 2.7n ⑶B ⑷
5]我国南方某些地区的井水取来久置后,井水由澄清透明变成有少量棕红色絮状沉淀积于缸底,水面浮着一层“锈皮”,当地居民常采用加明矾的方法处理。
⑴井水久置后,水面浮着的一层“锈皮”的主要成分是(写化学式) 。
⑵用化学方法鉴别该井水的步骤是
离子方程式是 。
⑶用化学方法鉴别经明矾处理后的水的步骤是
离子方程式是 。
[命题解读]有关水的问题与人民的生活联系都很密切。《考试说明》要求“了解化学在水处理中的应用。”本题以一个实际问题为背景考查了学生对这一部分知识的理解掌握程度。这一类题一般会涉及到水的净化过程,一般较为综合,但以考查学生的基础知识为主。
[解题指导]从现象来看,产生的的锈皮应是铁锈,说明该水中含有大量度Fe3+。要验证该水的成分只要检验水中的铁离子就行。而用明矾处理后的水中必然含有硫酸根离子,所以加入含有钡离子的可溶性物质即可达到目的。
答案:(1)Fe2O3·xH2O(2)取少量水向其中加入适量的盐酸,然后再向其中滴入KSCN溶液,如果变红色说明其中含有Fe3+ Fe3+ +3SCN -=Fe(SCN)3(3) 取少量水样于试管中加入少量BaCl2溶液,如产生明显的白色沉淀,即为用明矾处理过的井水. (若检验铝离子,写出实验步骤,现象和相应的离子方程式正确,同样可以) Ba2++SO42-=BaSO4↓ .
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com