
1. (08山东卷)某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
(08山东卷)某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
A.加入Na2SO4可以使溶液由a点变到b点
B.通过蒸发可以使溶液由d点变到c点
C.d点无BaSO4沉淀生成
D.a点对应的Kap大于c点对应的Kap
0.010+2x)2·x=1.1×10-12 ∵ x很小,∴ 0.010+2x≈0.010
x=1.1×10-8(mol·L-1) ∴ c(Ag2CrO4)=1.1×10-8 (mol·L-1)
∴ c(AgCl)>c(Ag2CrO4)

0.010+x)·x=1.8×10-10 ∵ x很小,∴ 0.010+x ≈0.010
x=1.8×10-8(mol·L-1)
c(AgCl)= 1.8×10-8(mol·L-1)
Ag2CrO4(s)  2Ag+(aq) + CrO2-4(aq)
2Ag+(aq) + CrO2-4(aq)
溶解平衡时: 0.010+x x
3.简述新方法生产效率高、成本低的原因
答案:(1)BaS+CuO+9H2O=Ba(OH)2·8H2O+CuS[也可写Ba(OH)2]
(2)CuS的溶度积比CuO小得多(更难溶),有利于该反应正向进行。
(3)CuS为难溶物(未反应的CuO也不溶),过滤后,将滤液浓缩、冷却,就可在溶液中析出Ba(OH)2·8H2O晶体,故生产效率高;CuS在空气中焙烧氧化可得CuO与SO2,故CuO可反复使用(SO2可用于制硫的化合物),因而成本低。
变式训练2、牙齿表面由一层硬的、组成为Ca5(PO4)3OH的物质保护着,它在唾液中存在下列平衡:Ca5(PO4)3OH(固) 5Ca2++3PO43-+OH-
进食后,细菌和酶作用于食物,产生有机酸,这时牙齿就会受到腐蚀,其原因是
已知Ca5(PO4)3F(固)的溶解度比上面的矿化产物更小,质地更坚固。主动脉用离子方程式表示,当牙膏中配有氟化物添加剂后能防止龋齿的原因:
5Ca2++3PO43-+OH-
进食后,细菌和酶作用于食物,产生有机酸,这时牙齿就会受到腐蚀,其原因是
已知Ca5(PO4)3F(固)的溶解度比上面的矿化产物更小,质地更坚固。主动脉用离子方程式表示,当牙膏中配有氟化物添加剂后能防止龋齿的原因:
根据以上原理,请你提出一种其它促进矿化的方法:
例3、一定温度下,难溶电解质在饱和溶液中各离子浓度幂的乘积是一个常数,这个常数称为该难溶电解质的溶度积,用符号Ksp表示
即:AmBn(s) mAn+(aq)+nBm-(aq) [An+]m·[Bm-]n=Ksp
mAn+(aq)+nBm-(aq) [An+]m·[Bm-]n=Ksp
已知:某温度时,Ksp(AgCl)=[Ag+][Cl-] =1.8×10-10
Ksp(Ag2CrO4)=[Ag+]2[CrO2- 4] =1.1×10-12
试求:(1)此温度下AgCl饱和溶液和Ag2CrO4饱和溶液的物质的量浓度,并比较两者的大小。(2)此温度下,在0.010mo1·L-1的AgNO3溶液中,AgCl与Ag2CrO4分别能达到的最大物质的量浓度,并比较两者的大小
答案:①AgCl(s) Ag+(aq)+Cl-(aq)
Ag+(aq)+Cl-(aq)
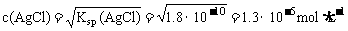
Ag2CrO4(s)  2Ag+(aq)+CrO42-(aq)
2Ag+(aq)+CrO42-(aq)
2x x
(2x)2·x=Ksp

∴ c(AgCl)<c(Ag2CrO4)
②在0.010 mol·L-1 AgNO3溶液中,c(Ag+)=0.010 mol·L-1
AgCl(s)  Ag+(aq) + Cl-(aq)
Ag+(aq) + Cl-(aq)
溶解平衡时: 0.010+x x
2.该反应反应物CuO是不溶物,为什么该反应还能进行:
当Qc 大于 Ksp时,情况为:__ _
当Qc 等于 Ksp时,情况为:__ _____
当Qc 小于 Ksp时,情况为:__ _____
①将AgNO3溶液依次加入氯化钠溶液、溴化钠溶液、碘化钾溶液中都会出现不同颜色的沉淀,沉淀的颜色变化是 _ ____ → _ _ ___ → ____ _。出现这种颜色变化的原因是:
_ _____ _
②将足量BaCO3分别加入:① 30mL 水 ②10mL 0.2mol/LNa2CO3溶液 ③50mL 0.01mol/L 氯化钡溶液 ④100mL 0.01mol/L盐酸中溶解至溶液饱和。请确定各溶液中Ba2+的浓度由大到小的顺序为: _____
例1.铝和镓的性质相似,如M(OH)3都是难溶的两性氢氧化物。在自然界镓常以极少量分散于铝矿,如Al2O3中。用NaOH溶液处理铝矿(Al2O3)时,生成NaAlO2、NaGaO2;而后通入适量CO2,得Al(OH)3沉淀,而NaGaO2留在溶液中(循环多次后成为提取镓的原料)。发生后一步反应是因为
A.镓酸酸性强于铝酸 B.铝酸酸性强于镓酸
C.镓浓度小,所以不沉淀 D.Al(OH)3是难溶物
答案:A
[变式训练1]己知碳酸钙和氢氧化钙在水中存在下列溶解平衡Ca(OH)2(固) Ca2++2
Ca2++2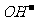 ,CaCO3(固)
,CaCO3(固)  Ca2++
Ca2++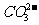 。在火力发电厂燃烧煤的废气中往往含有SO2、O2、N2,CO2等,为了除去有害气体SO2变废为宝,常常见粉末状的碳酸钙或熟石灰的悬浊液洗涤废气,反应产物为石膏
。在火力发电厂燃烧煤的废气中往往含有SO2、O2、N2,CO2等,为了除去有害气体SO2变废为宝,常常见粉末状的碳酸钙或熟石灰的悬浊液洗涤废气,反应产物为石膏
(1)写山上述两个反应的化学方程式:
①S02与CaCO3悬浊液反应
②S02与Ca(OH)2悬浊液反应
(2)试说明用熟石灰的悬浊液而不用澄清石灰水的理由
例2.以BaS为原料制备Ba(OH)2·8H2O的过程是:BaS与HCl反应,所得溶液在70℃-90C时与过量NaOH溶液作用,除杂,冷却后得到Ba(OH)2·8H2O晶体。据最新报道,生产效率高、成本低的Ba(OH)2·8H2O晶体的新方法是使BaS与CuO反应……
1.新方法的反应方程式为:
4.溶度积KSP的意义
反映了难溶电解质在水中的__ ______ ___,
KSP的大小和溶质的溶解度不同,它只与__ ______ 有关,与__ ______ 无关。
利用溶度积KSP可以判断__ _ __、__ _ __以及__ __ _ __。
3.难溶电解质在水中存在沉淀溶解平衡,其平衡常数称为____ __,简称____ __。
请写出PbI2 Cu(OH)2 BaSO4 CaCO3 Al(OH)3 CuS的沉淀溶解平衡与溶度积KSP表达式
2.难溶电解质在水中的沉淀溶解平衡和化学平衡、电离平衡一样,合乎平衡的基本特征、满足平衡的变化基本规律,
其基本特征为:
1.一些电解质如BaSO4在水中只能溶解很少、可以说是难以溶解,所以称为_____。尽管这些电解质难以溶解于水中,但在水中也会建立一种_____________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com