
6.下列说法正确的是 ( )
A.两难溶电解质作比较时,Ksp小的,溶解度一定小;
B.欲使溶液中某离子沉淀完全,加入的沉淀剂应该是越多越好;
C.所谓沉淀完全就是用沉淀剂将溶液中某一离子除净;
D.欲使Ca2+离子沉淀最完全,选择Na2C2O4作沉淀剂效果比Na2CO3好。
5. 下列说法正确的是 ( )
A.在一定温度下AgCl水溶液中,Ag+和Cl-浓度的乘积是一个常数;
B.AgCl的Ksp = 1.8×10-10 mol2·L-2,在任何含AgCl固体的溶液中,c(Ag+) = c(Cl-)且Ag+与Cl-浓度的乘积等于1.8×10-10 mol2·L-2;
C.温度一定时,当溶液中Ag+和Cl-浓度的乘积等于Ksp值时,此溶液为AgCl的饱和溶液;
D.向饱和AgCl水溶液中加入盐酸,Ksp值变大。
4.向同浓度的Cu2+、Zn2+、Hg2+、Mn2+离子混合溶液中通入H2S气体,则产生沉淀的先后次序是 ( )
A.CuS、HgS、MnS、ZnS; B.HgS、CuS、ZnS、MnS;
C. MnS、ZnS 、CuS、HgS、 D. HgS、ZnS、CuS、MnS
3.下列沉淀能溶解于盐酸的是 ( )
A.HgS; B.Ag2S C.MnS; D.CuS
2.在含有Mg(OH)2沉淀的饱和溶液中加入固体NH4Cl后,则Mg(OH)2沉淀 ( )
A.溶解; B.增多; C.不变; D.无法判断
1. 难溶电解质AB2饱和溶液中,c(A+) = xmol·L-1,c(B-) = ymol·L-1,则Ksp值为 ( )
难溶电解质AB2饱和溶液中,c(A+) = xmol·L-1,c(B-) = ymol·L-1,则Ksp值为 ( )
A. ; B.xy; C.xy2 D.4xy2
1、向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时, =
。
=
。
[Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]

4. (08江苏卷)工业上制备BaCl2的工艺流程图如下:

某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验。查表得
BaSO4(s) + 4C(s) 4CO(g) +
BaS(s) △H1 = 571.2 kJ·mol-1 ①
4CO(g) +
BaS(s) △H1 = 571.2 kJ·mol-1 ①
BaSO4(s) + 2C(s) 2CO2(g)
+ BaS(s) △H2= 226.2 kJ·mol-1 ②
2CO2(g)
+ BaS(s) △H2= 226.2 kJ·mol-1 ②
3.(08广东卷)已知Ag2SO4的KW 为2.0×10-3,将适量Ag2SO4固体溶于100
mL水中至刚好饱和,该过程中Ag+和SO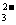 浓度随时间变化关系如右图(饱和Ag2SO4溶液中c(Ag+)=0.034 mol·L-1)。若t1时刻在上述体系中加入100 mL. 0.020 mol·L-1
Na2SO4 溶液,下列示意图中,能正确表示t1时刻后Ag+和SO
浓度随时间变化关系如右图(饱和Ag2SO4溶液中c(Ag+)=0.034 mol·L-1)。若t1时刻在上述体系中加入100 mL. 0.020 mol·L-1
Na2SO4 溶液,下列示意图中,能正确表示t1时刻后Ag+和SO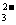 浓度随时间变化关系的是
( )
浓度随时间变化关系的是
( )
2. (09年广东化学·22)(12分)
某工厂生产硼砂过程中产生的固体废料,主要含有MgCO3、MgSiO3、 CaMg(CO3)2、Al2O3和Fe2O3等,回收其中镁的工艺流程如下:

|
沉淀物 |
Fe(OH)3 |
Al(OH)3 |
Mg(OH)2 |
|
pH |
3.4 |
5.2 |
12.4 |
部分阳离子以氢氧化物形式完全深沉时溶液的pH由见上表,请回答下列问题:
(1)“浸出”步骤中,为提高镁的浸出率,可采取的措施有 (要求写出两条)
(2)滤渣I的主要成分有 。
 (3)从滤渣Ⅱ中可回收利用的主要物质有 。
(3)从滤渣Ⅱ中可回收利用的主要物质有 。
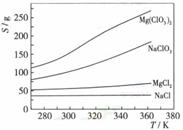
(4)Mg(ClO3)2在农业上可用作脱叶剂、催熟剂,可采用复分解反应制备:
MgCl2+2NaClO3===Mg(ClO3)2+2NaCl
已知四种化合物的溶解度(S)随温度(T)变化曲线如下图所示:
①将反应物按化学反应方程式计量数比混合制备Mg(ClO3)2.简述可制备Mg(ClO3)2的原因: 。
②按①中条件进行制备实验。在冷却降温析出Mg(ClO3)2过程中,常伴有NaCl析出,原因是: 。除去产品中该杂质的方法是: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com