
5.菜温度下将氯气通入氢氧化钾溶液里,反应后得到KCI、KClO、KClO3的混合溶液。经测定ClO和ClO3的浓度之比为11:l,则氯气和氢氧化钾溶液反应时,被还原的氯元素和被氯化的氧元素的物质的量之比为 ( )
A.1:3 B.4:3 C.2:l D.3:l
4.氢氧化铁胶体稳定存在的主要原因是 ( )
A.胶粒直径小于1nm B.胶体有丁达尔现象
C.胶粒带正电荷 D.胶粒不能通过半透膜
3.有关晶体的叙述正确的是 ( )
A.在SiO2晶体中,由Si、O构成的最小单元环是8元环
B.在12g金刚石中,含C-C共价键键数为4NA个
C-在60g二氧化硅中,含Si2O共价键键数为4NA个
D.在NaCl晶体中,与Na+最近且距离相等的Na+有6个
2.根据下列实验事实,能确定某晶体一定是离子晶体的是 ( )
A.晶体熔点达2500℃ B.晶体不导电,溶于水导电
C.晶体不导电,熔融能导电 D.温度越高,溶解度越大
1.下列关予溶液和胶体的叙述,正确的是 ( )
A.溶液是电中性的,胶体是带电的
B.通电时,溶液中的溶质粒子分别向两极移动,胶体中的分散质粒子向某一级移动
C.溶液中溶质分子的运动有规律,胶体中分散质粒子的运动无规律,即布朗运动
D.一束光线分别通过溶液和胶体对,后者会出现明显的光带,前者则没有
3、Fe2+、Fe3+的性质及检验
(1)Fe2+ 的性质
①水溶液是 色
②与KSCN溶液 ,再滴 则变红
③与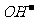 反应 现象:
-→
-→
反应 现象:
-→
-→
反应方程式: 、
④既有 又有 ,但主要体现 。
Fe2+ 可被强氧化剂(如 )可将Fe2+氧化成Fe3+。
(2)Fe3 +的性质
①水溶液是 色
②与KSCN溶液 ,反应方程式
③与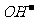 反应 现象:
反应方程式:
反应 现象:
反应方程式:
④只有 性,Fe3+可被还原剂(如 )可将Fe3+还原成Fe2+。
⑤Fe3+有较强水解能力。
水解方程式为:
思考:①能用加热蒸发FeCl3溶液得获得FeCl3固体吗?Fe2(SO4)3呢?
②Fe3+与 、、
、、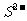 能共存吗?
能共存吗?
(3)Fe2+、Fe3+的检验
①检验Fe2+的方法:
(a)KSCN法:先滴加KSCN溶液,若溶液不显血红色,再滴加氯水,若溶液显血红色。说明原溶液中有Fe2+。
(b)碱液法:现象
②检验Fe3+的方法
(a)KSCN法: 现象
(b)碱液法: 现象
(c)苯酚法: 现象
试题枚举
[例1]在铁和铜的混合物中,加入不足量的稀硝酸,反应后剩余金属m1g;再向其中加入一定量的稀硫酸,充分振荡后 ,剩余金属m2g,则m1和 m2之间的关系是( )
A.m1一定大于m2 B.m1 可能等于m2
C.m1一定等于m2 C.m1 可能大于m2
解析: m1g金属中的金属有两种情况(1)只有铜(2)铜、铁都有,加入稀硫酸后,若认为稀硫酸只和铁反应,则会选择B、C。其实加入稀硫酸后,原溶液中的NO3-和稀硫酸中的H+共存,相当于有稀硝酸,则铜、铁都可继续反应。
答案:A
[变式]将铁屑溶于过量盐酸后,再加入下列物质,会有三价铁生成的是
A.硫酸 B.氯水 C.硝酸锌 D.氯化铜
答案:C
[例2] 一定量的Fe和Fe2O3的混合物投入250 ml 2 mol/L硝酸溶液中,反应完全后,生成1.12 L NO(标况),再向反应后的溶液中加入1mol/LNaOH溶液,要使铁元素完全沉淀下来,所加入的NaOH溶液体积最少是( )
A、450 ml B、500 ml C、400 ml D、不能确定
解析: 本题涉及到的反应较多,况且铁最终是以Fe (OH)3还是 Fe (OH)2形式沉淀,难以确定;硝酸是否过量也不能确定,看来计算很困难。但若从NaOH考虑,加入的NaOH恰好使铁元素沉淀,溶液为硝酸钠溶液。不难得出:
n(NaoH)=n(NO3-)=n(HNO3)-n(NO)= 0.25LΧ2 mol/L-0.5 mol=0.45mol
V(NaoH)=0.45L=450 ml
答案: A
[变式] 在由Fe、FeO、和Fe2O3组成的混合物中加入100mL2mol/L的盐酸,恰好使混合物完全溶解,并放出448mL气体(标准状况),此时溶液中无Fe3+离子,则下列判断正确的是( )
A.混合物里3种物质反应时消耗盐酸的物质的量浓度之比为1:1:3
B.反应后所得溶液中的Fe2+离子与Cl-离子的物质的量浓度之比为1:2
C.混合物里,FeO的物质的量无法确定,但Fe比Fe2O3的物质的量多
D.混合物里,Fe2O3的物质的量无法确定,但Fe比FeO的物质的量多
[例3]下列离子方程式书写正确的是( )
A.向溴化亚铁溶液中通入过量氯气:Fe2++2Br-+2Cl2==Fe3+ + Br2+ 4Cl-
B.三氯化铁溶液跟过量氨水反应 Fe3++3NH3•H2O == Fe(OH)3↓+3NH4+
C.硫化亚铁与盐酸反应 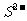 +2H+==H2S↑
+2H+==H2S↑
D.过量铁粉与稀HNO3反应:Fe+4H++NO3-= Fe3++NO↑+2H2O
解析: Cl2与FeBr2溶液反应,由于还原性Fe2+>Br-,Cl2应先氧化Fe2+,待Fe2+被氧化完全后再氧化Br-。当Cl2少量时,离子方程式为:Cl2 +2Fe2+ ==2Fe3+ +2 Cl-,当过量时:离子方程式为:3 Cl2 +2Fe2++4Br-== 2Fe3+ +6Cl-+2Br2, 所以A错。铁与稀HNO3反应,当Fe少量时,离子方程式为: Fe+4H++NO3-== Fe3++NO↑+2H2O;当Fe过量时,离子方程式为: 3Fe+8H++2NO3-== 3Fe2++2NO↑+4H2O,所以D错。C项FeS为难溶物,不能拆开写成离子形式。。
答案: B
[变式]下列各组离子一定能大量共存的是
A.在含大量Fe3+的溶液中
NH4+、Na+、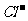 、SCN-
、SCN-
B.在强碱性溶液中
Na+、K+、 、
、
C.在c(H+)=10-13mol·L-1的溶液中 NH4+、Al3+、 、
、
D.在pH=1的溶液中 K+、Fe2+、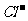 、
、
答案:B
[例4]在铁和氧化铁的混合物15g中加入150mL稀H2SO4放出氢气1.68L(标准状况)。当反应停止后,铁和氧化铁均无剩余,且溶液中无Fe3+存在。为了中和过量H2SO4,并 使Fe2+完全转化为Fe(OH)2沉淀,共耗用3 mol/L NaOH,溶液200mL。求:
①混合物中铁和氧化铁各多少克?
②稀H2SO4的物质的量浓度为多少?
解析:(1)解:设铁和氧化铁的物质的量分别为x和y,则
x×56g/mol+y×160 g/mol=15g……………①
由得失电子守恒得,x×2=y×2+1.68L/22.4L/mol×2……………②
解得:x=0.25mol, y=0.05mol.即m(Fe)=0.25mol×56g/mol=7g, m(Fe2O3)=0.05mo l×160g/mol=8g
(2)在铁和氧化铁的混合物中加入稀H2SO4反应停止后,溶液中的溶质主要是H2SO4 和FeSO4。
由电荷守恒知:硫酸中的硫酸根离子最后完全和钠离子结合在一起。
n(H2SO4)=1/2×3 mol/L×0.2L=0.3mol
c(H2SO4)=0.3 mol/0.15L=2 mol/L
21世纪教育网
2、铁的氢氧化物
|
化学式 |
Fe(OH)2 |
Fe(OH)3 |
|
|
名称 |
|
|
|
|
物理 性质 |
色、态 |
|
|
|
水溶性 |
|
||
|
酸碱性 |
|
||
|
与酸 反应 |
盐酸 |
|
|
|
硝酸 |
|
||
|
稳定性 |
|
|
|
|
实验室制备 |
|
|
思考: ①如何避免制取Fe(OH)2时Fe2+被氧化变质?
②如何制备氢氧化铁胶体?
1、铁的氧化物
|
化学式 |
FeO |
Fe2O3 |
Fe3O4 |
|
|
名称(俗名) |
|
|
|
|
|
色、态 |
|
|
|
|
|
溶解性 |
都难溶于水 |
|||
|
金属价态 |
|
|
|
|
|
与HCl反应 |
|
|
|
|
|
与HNO3反应 |
|
|
||
|
与HI反应 |
|
|
|
|
|
与 还 原 剂 (高温) |
H2 |
|
|
|
|
CO |
|
|
|
|
|
Al |
|
|
|
|
|
稳定性 |
|
|
||
|
用途 |
|
|
|
2、化学性质
铁是 的金属,通常显+2、+3价
思考:比较Fe3+与Fe2+的电子排布式,谁稳定?
(1)与非金属单质反应
①与O2反应:
②与Cl2反应:
③与S反应:
(2)与水反应
①与水蒸汽反应
②常温下,铁与水不起反应,但潮湿的空气里,铁易被腐蚀,形成铁锈。
反应方程式为: 、
(3)与酸反应
①非氧化性酸(如稀硫酸、盐酸)
现象: 反应离子方程式:
②氧化性酸:
常温下,铁遇浓硫酸、浓硝酸会 。
(a) 与过量稀HNO3反应
(b) 过量的Fe与稀 HNO3反应
(c) 与浓HNO3共热
(4)与盐溶液反应
①与CuSO4反应:
②与FeCl3反应:
思考:铁与其他物质反应时,何时生成+2价铁的化合物?何时生成+3价铁的化合物?
1、物理性质:
银白色光泽、密度大,熔沸点高,延展性、导电、导热性较好、能被磁铁吸引。
思考:纯铁抗蚀能力特别强,而我们常见的铁并非如此,为什么?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com