
3. 某溶液既能溶解Al(OH)3,又能溶解H2SiO3,在该溶液中可以大量共存的离子组是( )
A.K+、Na+、 、
、 B.Na+、
B.Na+、 、
、 、
、
C.H+、Mg2+、SO42-、 - D.Ag+、K+、
- D.Ag+、K+、 、Na+
、Na+
[答案]B
2. 若溶液中由水电离产生的 =1×10-14mol·L-1,此溶液中一定可以大量共存的离子组是
( )
=1×10-14mol·L-1,此溶液中一定可以大量共存的离子组是
( )
A. Al3+ 、Na+ 、 、
、 B. K+ 、Na+、
B. K+ 、Na+、 、
、
C. K+ 、Na+ 、 、
、 D. K+ 、 NH4+、
D. K+ 、 NH4+、 、
、
[答案]B
1.下列化学反应的离子方程式正确的是 ( )
A.溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+==AgBr↓
B.少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-=CaSO3 +2HClO
+2HClO
C.利用腐蚀法制作印刷线路板:Fe3+ + Cu == Fe2+ + Cu2+
D.氢氧化钙溶液与等物质的量的稀硫酸混合:Ca2++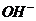 +H++SO
+H++SO =CaSO4
=CaSO4 +H2O
+H2O
E.用醋酸除去水垢:CaCO3 + 2H+==Ca2+ + H2O + CO2↑
F.苯酚钠溶液中通入少量CO2:CO2 + H2O + 2C6H5O- 2C6H5OH
+ 2
2C6H5OH
+ 2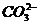
G.钠与水的反应:Na+H2O=Na++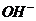 +H2↑
+H2↑
H.氯气与水反应:Cl2+H2O=2H++ +
+
I.石灰乳与Na2CO3溶液混合:Ca2++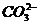 =CaCO3
=CaCO3
J.NH4HSO3溶液与足量的NaOH溶液混合加热:
 +
+ +2
+2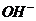
 NH3Ÿ+
NH3Ÿ+ +2H2O
+2H2O
K.硫酸铜与烧碱反应:CuSO4+2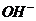 ===Cu(OH)2↓+
===Cu(OH)2↓+
L.苯酚与碳酸钠反应:2C6H5OH+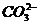 ===2C6H5O-+CO2↑+H2O
===2C6H5O-+CO2↑+H2O
M.碳酸钡与硫酸反应:Ba2++ ===BaSO4↓
===BaSO4↓
N.足量的硫酸铝与纯碱反应:2Al3++3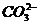 +3H2O===2Al(OH)3↓+3CO2↑
+3H2O===2Al(OH)3↓+3CO2↑
[答案]J、N
17. 某厂的酸性工业废水中含有一定量的Fe3+、Cu2+、Au3+等离子。有人设计了图中的工艺流程,利用常用的酸、碱和工业生产中的废铁屑,从废水中回收金,并生产一定量的铁红和氧化铜21世纪教育网
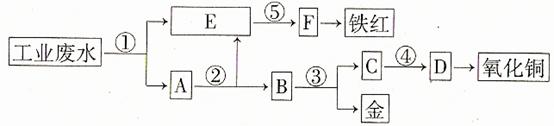
填写下面空白。
(1)图中标号处需加入的相应物质分别是① 、② 、③ 、④ 、⑤ ;
(2)写出①处发生反应的离子方程式 ;写出③处发生反应的化学方程式 ;
(3)铁红的化学式为 ;分别写出铁红和氧化铜在工业上的一种主要用途:铁红 ;氧化铜 。
[答案](1)①铁屑 ②稀硫酸 ③稀硝酸 ④氢氧化钠 ⑤氢氧化钠
(2)Fe+2H+=Fe2++H2↑ 2Fe3++Fe=3Fe2+
Cu2++Fe=Cu+Fe2+ 2Au +3Fe=2Au+3Fe2+
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
(3)Fe2O3 用作红色涂料 用作制造铜盐的原料
[解析]首先用过量铁屑将H+、Fe3+、Cu2+、Au3+等离子还原成H2、Fe2+、Cu、Au,发生4个反应,E中应为Fe2+,因为后面生成铁红,故⑤为碱液氢氧化钠,试剂②是将过量铁屑溶解,试剂③是将Cu、Au分离应为稀硝酸,从C中的Cu2+到氧化铜,也应为碱液氢氧化钠。
[考点分析]有关离子反应的综合运用21世纪教育网
[专题突破]
16. 下列溶液中微粒的物质的量浓度关系正确的是 ( )
A.室温下,向0.01mol·L-1NH4HSO4溶液中滴加NaOH溶液至中性:
c(Na+)>c( )>c(
)>c( )>c(
)>c(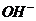 )=c(H+)
)=c(H+)
B.0.1mol·L-1NaHCO3溶液:c(Na+)>c(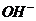 )>c(
)>c( )>c(H+)
)>c(H+)
C.Na2CO3溶液:c(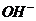 )-c(H+)=c(
)-c(H+)=c( )+2c(H2CO3)
)+2c(H2CO3)
D.25℃时,pH=4.75、浓度均为0.1mol·L-1的CH3COOH、CH3COONa混合溶液: c( )+c(
)+c(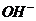 )<c(CH3COOH)+c(H+)
)<c(CH3COOH)+c(H+)
[答案]AC
[解析]B项,NaHCO3溶液中,OH-是由HCO3- 水解和水的电离所出成的,但是这些都是微弱的。HCO3- 的浓度永大于OH-浓度,故错;D项,由电荷守恒有:c( )+c(
)+c(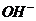 )=c(H+)+c(Na+) ,由物料守恒可得:2c(Na+)= c(
)=c(H+)+c(Na+) ,由物料守恒可得:2c(Na+)= c( )+ c(CH3COOH),将两式中的c(Na+) 消去,可得c(
)+ c(CH3COOH),将两式中的c(Na+) 消去,可得c( )+2c(OH-)=2c(H+)+ c(CH3COOH)。所以c(
)+2c(OH-)=2c(H+)+ c(CH3COOH)。所以c( )+c(
)+c(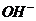 )-c(H+)-c(CH3COOH)= c(H+)-c(
)-c(H+)-c(CH3COOH)= c(H+)-c(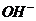 ),因为pH=4.75,故
),因为pH=4.75,故
c(H+)-c(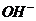 )>0,所以D项不等式应为”>” ,故错。
)>0,所以D项不等式应为”>” ,故错。
[考点分析]
①混合溶液中离子浓度的关系,电荷守恒。
②等pH的溶液中物质的量浓度的大小关系
③电离和水解的相互关系
④酸式盐溶液中离子的浓度大小关系
15. 某酸性溶液中只有Na+、 、H+、
、H+、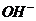 四种离子。则下列描述正确的是( )
四种离子。则下列描述正确的是( )
A.该溶液由pH=3的CH3COOH与pH=11的NaOH溶液等体积混合而成
B.该溶液由等物质的量浓度、等体积的NaOH溶液和CH3COOH溶液混合而成
C.加入适量的NaOH,溶液中离子浓度为c( )>c(Na+)>c(OH-)>c(H+)
)>c(Na+)>c(OH-)>c(H+)
D.加入适量氨水,c( )一定大于c(Na+)、c(NH4+)之和
)一定大于c(Na+)、c(NH4+)之和
[答案]A
[解析]此题的关键应注意题中的“酸性”两个字,选项B溶液NaOH与CH3COOH恰好完全反应,所以溶液呈碱性;选项C中当加入NaOH后溶液仍然呈酸性,则c(H+)>c(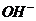 ),不成立,当恰好完全反应,溶液呈碱性,则c(Na+)>C(
),不成立,当恰好完全反应,溶液呈碱性,则c(Na+)>C( ),当碱过量时,必定c(Na+)>C(
),当碱过量时,必定c(Na+)>C( ),所以在任何情况下溶液的离子关系都不能成立;选项D中加入氨水,由电荷守恒得:c(
),所以在任何情况下溶液的离子关系都不能成立;选项D中加入氨水,由电荷守恒得:c( )+c(OH-)=c(Na+)+c(NH4+)+c(H+),当溶液仍呈酸性即c(OH-)<c(H+),则c(
)+c(OH-)=c(Na+)+c(NH4+)+c(H+),当溶液仍呈酸性即c(OH-)<c(H+),则c( )>c(NH4+)+c(Na+);当溶液呈中性时,c(H+)=c(OH-),则c(
)>c(NH4+)+c(Na+);当溶液呈中性时,c(H+)=c(OH-),则c( )=c(
)=c( )+c(Na+);当溶液呈碱性时,c(H+)<c(
)+c(Na+);当溶液呈碱性时,c(H+)<c(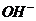 ),则c(
),则c( )<c(
)<c( )+c(Na+),所以c(
)+c(Na+),所以c( )一不定大于c(Na+)、c(
)一不定大于c(Na+)、c( )之和。
)之和。
[考点分析]溶液中离子浓度大小比较。
14. 用物质的量都是0.1 mol的CH3COOH和CH3COONa配制成1L混合溶液,已知其中
C( )>C(Na+),对该混合溶液的下列判断正确的是
( )
)>C(Na+),对该混合溶液的下列判断正确的是
( )
A.C(H+)>C(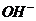 )
)
B.C(CH3COOH)+C( )=0.2 mol/L
)=0.2 mol/L
C.C(CH3COOH)>C( )
)
D.C( )+C(OH-)=0.2 mol/L
)+C(OH-)=0.2 mol/L
[答案]B
[解析]CH3COOH和CH3COONa的混合溶液中,CH3COOH的电离和CH3COONa的水解因素同时存在。已知C( )>C(Na+),根据电荷守恒C(
)>C(Na+),根据电荷守恒C( +C(OH-)=C(Na+)+C(H+),可得出C(
+C(OH-)=C(Na+)+C(H+),可得出C(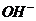 )<C(H+)。说明混合溶液呈酸性,进一步推测出0.1mol/L的CH3COOH和0.1mol/L的CH3COONa溶液中,电离和水解这一对矛盾中起主要作用是电离,即CH3COOH的电离趋势大于
)<C(H+)。说明混合溶液呈酸性,进一步推测出0.1mol/L的CH3COOH和0.1mol/L的CH3COONa溶液中,电离和水解这一对矛盾中起主要作用是电离,即CH3COOH的电离趋势大于 的水解趋势。根据物料守恒,可推出(B)是正确的21世纪教育网
的水解趋势。根据物料守恒,可推出(B)是正确的21世纪教育网
[考点分析]离子浓度大小比较。
13. 设计一个实验证明明矾晶体KAl(SO4)2·12H2O中含有K+、Al3+、 和H2O。
和H2O。
[答案及解析]应利用组分中各成分的特征反应进行单独鉴别,从而确定物质的组成。
实验设计:
(1)确定晶体中是否含有结晶水:取少量晶体,外观观察是一种无色晶体,放入试管中,用酒精灯加热在试管口有液态水生成,且可使白色无水硫酸铜粉末变蓝色,证明明矾中含结晶水21世纪教育网
(2)确定K+存在:用一支洁净的铂丝沾取少量试样,在酒精灯火焰上灼烧,透过蓝色的钴玻璃片观察火焰呈紫色,确定含K+。
(3)确定Al3+存在:中学阶段学过的金属阳离子有Mg2+、Al3+和Zn2+对应的氢氧化物为白色沉淀,其中Al (OH)3 和Zn(OH)2 属于两性氢氧化物,而Zn(OH)2又能溶于过量氨水,所以要排除Mg2+和Zn2+的可能性。将晶体溶于蒸馏水,配成溶液,取出少量溶液分装在两支试管中。
第一支试管中滴加少量NaOH溶液,出现白色沉淀,将此白色沉淀分成三份。
第一份继续加入过量NaOH溶液,白色沉淀溶解。
第二份加入过量盐酸溶液,白色沉淀也溶解,证明此白色沉淀可能是两性氢氧化物Al (OH)3 或Zn(OH)2排除镁离子的可能性。
第三份加入过量氨水,白色沉淀不溶,说明不是Zn(OH)2只能是Al (OH)3,进一确定Al3+存在。
(4)确定 离子存在:第二支试管中先加盐酸溶液,如无现象,证明无
离子存在:第二支试管中先加盐酸溶液,如无现象,证明无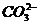 、
、 存在,再加入BaCl2溶液生成白色沉淀证明溶液中含
存在,再加入BaCl2溶液生成白色沉淀证明溶液中含
综上所述,通过以上实验可证明明矾晶体中成分含K+、Al3+、 和H2O。
和H2O。
[考点分析]常见离子的检验
12. (1)向NaHSO4溶液中,逐滴加入Ba(OH)2溶液中至中性,请写出发生反应的离子方程式: 。
(2)在以上中性溶液中,继续滴加Ba(OH)2溶液,请写出此步反应的离子方程式 。
[答案]2H+ +  +
Ba2+ + 2
+
Ba2+ + 2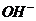 =
BaSO4 ↓ + 2H2O
=
BaSO4 ↓ + 2H2O
Ba2+ +  = BaSO4 ↓
= BaSO4 ↓
[解析]题目要求NaHSO4溶液与Ba(OH)2溶液反应呈中性,也即要求写出的离子方程式属于下列反应 2NaHSO4 + Ba(OH)2 = 2H2O + Na2SO4 + BaSO4↓。则离子方程式为:2H+ +  + Ba2+
+ 2
+ Ba2+
+ 2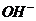 =
BaSO4 ↓ + 2H2O 。若向上述溶液中继续滴加B(OH)2,则有 Ba2+ +
=
BaSO4 ↓ + 2H2O 。若向上述溶液中继续滴加B(OH)2,则有 Ba2+ +  =
BaSO4 ↓
=
BaSO4 ↓
[考点分析]书写新情境下的离子方程式。
3.本题还有很大的拓展空间:如根据电荷守恒是否可以推出K+ 的物质的量一定是0.02mol吗?结论也是不一定,如果不含有 则根据电荷守恒知K+是0.02mol,如果溶液中含有含有
则根据电荷守恒知K+是0.02mol,如果溶液中含有含有 ,则K+的物质的量大于0.02mol。
,则K+的物质的量大于0.02mol。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com