
5、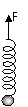 如图所示,手提一根不计质量的、下端挂有物体的弹簧,竖直向上做加速运动,当手突然停止运动的瞬时,物体将…………………………………………( )
如图所示,手提一根不计质量的、下端挂有物体的弹簧,竖直向上做加速运动,当手突然停止运动的瞬时,物体将…………………………………………( )
A. 处于静止状态
B. 向上做加速运动
C. 向上做匀速运动
D.向上做减速运动
4、如图所示,要使静止在粗糙斜面上的物体沿斜面下滑,可采用的方法( )
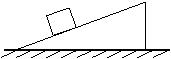 A. 对物体施加一个竖直向下的力
A. 对物体施加一个竖直向下的力
B. 减小物体的重力
C. 增大斜面的倾角
D.沿斜面在物体的上方紧靠物体放一个与原来物体完全相同的另一个物体。
3、如图、物体受到与水平方向成α角的力F的作用,在水平面上做匀加速直线运动,方向向右,物体受到的摩擦力与拉力的合力方向是……………………………( )
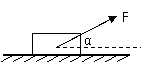 A. 竖直向上
A. 竖直向上
B. 竖直向下
C. 向上偏右
D.向上偏左
2、歹徒从行驶的火车上跳下来,容易倒向………………………………( )
A. 火车行驶的方向
B. 火车行驶的反方向
C. 火车的右侧
D.火车的左侧
1、关于运动和力的关系,下列说法错误的是………………………………( )
A. 力是运动状态改变的原因
B. 力是使物体位移不断增大的原因
C. 做匀速直线运动的物体必须受到平衡力的作用
D.只要物体运动轨迹发生弯曲,必然受到力的作用
高考对本部分内容考查的热点:一是化学键类型、分子极性的判断,解此类题时的依据是有关的基本概念如共价键的概念,形成化学键元素性质的差异大小,分子的空间构型等,在分析解答过程中要注意问题的隐含性。如NH4Cl中存在共价键,全都是由非金属原子构成的,但是离子化合物存在离子键。二是分子结构的确定,此类题目的特点是判断常见分子、离子的电子式的书写正误,或是综合化学键的知识考查分子的空间构型及分子的形成方式。三是晶体结构的确定及晶体物理性质的比较,此类题在高考中的比重有增大的趋势,难度也有所增加,对知识的要求比较细致深刻,应用能力要求较高。主要考查一些常见单质、化合物的晶体类型;判断晶体中基本粒子间的作用力是离子键、共价键还是分子间作用力,从而确定晶体的熔点高低。其次就是课本上出现过的晶体结构示意图。该类题目的特点:①由物质的性质或粒子间的作用力确定晶体类型,②依据比较晶体物理性质(主要是:硬度、熔点、沸点等)的规律,确定所给晶体硬度的大小,熔沸点的高低顺序。在解答过程中,首先要判断晶体类型,其次根据四类晶体(离子晶体、原子晶体、分子晶体、金属晶体)各自物理性质的主要影响因素(即粒子间的相互作用力的强弱)进行分析比较,最后要注意看准顺序要求。
由于晶体空间结构试题能很好地考查学生的观察能力和三维空间的想象能力,因而它成为命题的热点在情理之中。考查的形式或根据空间构型求晶体的化学式或根据空间构型求晶体密度、阿伏加德罗常数、化学键数目等,常与数学和物理知识综合在一起考查,特别易与立体几何知识结合在一起。此类试题立意新颖,构思巧妙,对学生的观察思维能力,空间想象能力有较高的要求。
[例题]晶体具有规则的几何外形,晶体中最基本的重复单位称为晶胞。NaCl晶体结构如图所示。已知FexO晶体晶胞为NaCl型,由于晶体缺陷,x值小于1。测知FexO晶体密度ρ为5.71 g·cm-3,晶胞边长为4.28×10-10 m(铁相对原子质量为55.9,氧相对原子质量为16)。求:
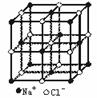
(1)FexO中x的值。
(2)晶体中的铁分别为Fe2+、Fe3+,在Fe2+和Fe3+的总数中,Fe2+所占的质量分数(用小数表示精确到0.001)。
(3)确定此晶体的化学式(化学式中表示出Fe2+和Fe3+的个数)。
(4)在该晶体中,铁元素的离子间的最短距离为多少米?
解答:考查晶体结构常以新情境(或信息题)的形式出现,要求考生在解题时展开丰富的空间想象、结合化学概念、充分运用数学或物理的思维方法,以及旋转、翻转、分割、延伸等手段解题。本题应抓住晶体中的电中性原则,充分利用数学知识,展开空间想象。
(1)1个晶胞中含4个FexO
6.02×1023×(4.28×10-8)3×5.71=4 M
M=67.4 g·mol-1 55.9x+16=67.4
故x=0.92
(2)设Fe2+为y个、则Fe3+为(0.92-y)个
2y+3×(0.92-y)=2 y=0.76
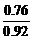 ×100%=82.6%
×100%=82.6%
(3)19 FeO·2Fe2O3;
(4)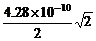 =3.03×10-10 m。
=3.03×10-10 m。
3.物质熔沸点高低比较规律
(1)不同晶体类型的物质的熔沸点高低顺序一般是:原子晶体>离子晶体>分子晶体。同一晶体类型的物质,则晶体内部结构粒子间的作用越强,熔沸点越高。
(2)原子晶体要比较共价键的强弱,一般地说,原子半径越小,形成的共价键的键长越短,键能越大,其晶体熔沸点越高。如熔点:金刚石>碳化硅>晶体硅。
(3)离子晶体要比较离子键的强弱。一般地说,阴阳离子的电荷数越多,离子半径越小,则离子间的作用就越强,其离子晶体的熔沸点就越高,如熔点:MgO>MgCl2>NaCl>CsCl。
(4)分子晶体:组成和结构相似的物质,相对分子质量越大,熔沸点越高,如:熔沸点:O2>N2,HI>HBr>HCl。组成和结构不相似的物质,分子极性越大,其熔沸点就越高,如熔沸点CO>N2。在同分异构体中,一般地说,支链数越多,熔沸点越低,如沸点:正戊烷>异戊烷>新戊烷;同分异构体的芳香烃及其衍生物,其熔沸点高低顺序是邻>间>对位化合物。
(5)金属晶体中金属离子半径越小,离子电荷数越多,其金属键越强,金属熔沸点就越高。
(6)元素周期表中第ⅦA族卤素的单质(分子晶体)的熔沸点随原子序数递增而升高;第ⅠA族碱金属元素的单质(金属晶体)的熔沸点随原子序数的递增而降低。
2.共价键的极性与分子极性关系规律
共价键包括非极性键和极性键。化学键有无极性,是相对共价键而言的,即共用电子对是否发生偏移。而共用电子对的偏移,又取决于成键原子吸引电子能力的大小。按上述推理归纳为:A-A型,即相同元素原子间成键形成的是非极性键;A-B型,即不同元素原子间成键形成的是极性键。
分子是否存在极性,不能简单地只看分子中的共价键是否有极性,而要看整个分子中的电荷分布是否均匀、对称。根据组成分子的原子种类和数目的多少,可将分子分为单原子分子、双原子分子和多原子分子,其各类分子极性的判断依据是:
(1)单原子分子:分子中不存在化学键,故没有极性分子或非极性分子之说,如He、Ne等。
(2)双原子分子:若含极性键,就是极性分子,如HCl、HBr等;若含非极性键,就是非极性分子,如O2、I2等。
(3)以极性键结合的多原子分子,主要由分子中各键在空间的排列位置决定分子的极性。若分子中的电荷分布均匀,即排列位置对称,则为非极性分子,如BF3、CH4等。若分子中的电荷分布不均匀,即排列位置不对称,则为极性分子,如NH3、SO2等。
1.化学键与物质类别关系规律
(1)只含非极性共价键的物质:同种非金属元素构成的单质,如:I2、N2、P4、金刚石、晶体硅等。
(2)只含有极性共价键的物质:一般是不同非金属元素构成的共价化合物,如:HCl、NH3、SiO2、CS2等。
(3)既有极性键又有非极性键的物质:如:H2O2、C2H2、CH3CH3、C6H6(苯)等。
(4)只含有离子键的物质:活泼非金属元素与活泼金属元素形成的化合物,如:Na2S、CsCl、K2O、NaH等。
(5)既有离子键又有非极性键的物质,如:Na2O2、Na2Sx、CaC2等。
(6)由离子键、共价键、配位键构成的物质,如:NH4Cl等。
(7)由强极性键构成但又不是强电解质的物质,如:HF。
(8)只含有共价键而无范德华力的化合物,如:原子晶体SiO2、SiC等。
(9)无化学键的物质:稀有气体,如氩等。
31.答案:(1)1s22s22p6 (2)NaOH>Mg(OH)2
(3)NH3+H2O NH3·H2O
NH3·H2O NH
NH +OH-
+OH-
(4)分子晶体 (5)OH- H3O+
●命题趋向与应试策略
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com