
2.已知N(3,1),点A、B分别在直线y=x和y=0上,则△ABN的周长的最小值是 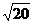 。
。
1.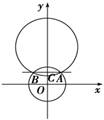 椭圆
椭圆 (a>b>0)的两焦点为F1F2,连接点F1,F2为边作正三角形,若椭圆恰好平分正三角形的另两条边,则椭圆的离心率为
(a>b>0)的两焦点为F1F2,连接点F1,F2为边作正三角形,若椭圆恰好平分正三角形的另两条边,则椭圆的离心率为 
(三) CuSO4及 CuSO4·5H2O
硫酸铜晶体(CuSO4·5H2O)俗名 或 。
CuSO4·5H2O受热分解的化学方程式为:
。
铜及其化合物的转化关系:
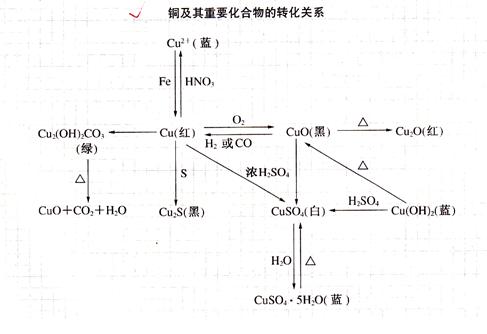
[夯实基础]
1. 2000年5月,保利集团在香港拍卖会上花费3000多万港币购回了在火烧圆明园时流失的国宝:铜铸的牛首、猴首和虎首。普通铜器稍久会出现铜绿Cu2(OH)2CO3,而三件1760年铜铸的国宝,在240年后看上去依然熠熠生辉。下列对其原因的分析,最可能的是( )
A. 它们的表面都镀上了耐腐蚀的黄金
B. 环境污染日趋严重,它们表面的铜绿被酸雨溶解洗去
C. 铜的金属活泼性比氢小,因此它们不易氧化
D. 它们是含一定比例金、银、锡、锌、铜的合金
2. 下列物质中,属于纯净物的是( )
A. 生铁 B. 青铜 C. 漂白粉 D. 胆矾
3. 写出下列反应的化学方程式,并标出电子转移的方向和数目:
①
Cu + 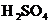 (浓)
(浓)
②
Cu +  (浓)
(浓)
③
Cu +  (稀)
(稀)
4. 写出下列反应的离子方程式:
① Fe + HCl(稀)
②
Cu +  (稀)
(稀)
5. 下列金属不能由电解其盐的水溶液来获得的是( )
A. Na B. Mg C. Cu D. Ag
6. 只用一种试剂即可区分下列化合物,该试剂可以是 。
AlCl3、MgCl2、FeCl2、CuCl2、FeCl3、 NaCl
7. 在含有Cu(NO3)2、Mg(NO3)2和AgNO3的溶液里加入适量锌粉,首先置换出的是( )
A. Mg B. Cu C. Ag D. H2
8. 在铜跟稀硝酸的反应中,如果有1 mol硝酸还原了,则被氧化的铜的物质的量为( )
A.  mol B.
mol B. 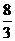 mol C.
mol C.  mol D.
mol D. 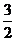 mol
mol
9. 铜粉放入稀硫酸溶液中,加热后无明显现象发生,当加入下列一种物质后,铜粉的质量减少,溶液呈兰色,同时有气体逸出,该物质是( )
A. Fe2(SO4)3 B. Na2CO3
C. 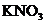 D.
FeSO4
D.
FeSO4
10. 用气体还原剂还原a g CuO,最终得到b g Cu,如氧的相对原子质量为16,则铜的相对原子质量为( )
A. 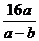 B.
B. 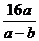 +16 C.
+16 C. 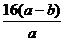 D.
D. 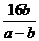
11. 某无色气体含有CO、CO2、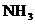 、HCl、H2和水蒸气中的一种或几种,当它依次通过澄清石灰水(无浑浊现象)、氢氧化钡溶液(有浑浊现象)、浓硫酸(无明显现象)、灼热的CuO(变红)和五水硫酸铜(变蓝)(假定每处均完全反应)。下列结论正确的是( )
、HCl、H2和水蒸气中的一种或几种,当它依次通过澄清石灰水(无浑浊现象)、氢氧化钡溶液(有浑浊现象)、浓硫酸(无明显现象)、灼热的CuO(变红)和五水硫酸铜(变蓝)(假定每处均完全反应)。下列结论正确的是( )
A.
肯定有CO、HCl,可能有 或H2其中之一
或H2其中之一
B. 肯定有H2、CO2、HCl,可能有CO和水蒸气
C. 肯定有H2、肯定没有CO2
D. 肯定有CO、CO2、H2,可能有HCl
12. 某不纯的铁片中,可能含有镁、铝、铜等金属杂质。取这种铁片5.6g,与足量的稀盐酸反应得到0.18gH2,则该铁片( )
A. 一定不含杂质
B 一定含铝
C. 一定同时含有三种金属杂质
D. 一定含有铜
13. 为了除去酸性氯化铝溶液中得Cu2+,下列实验步骤顺序和所用试剂都正确的是( )
① 通过CO2 ②加盐酸 ③加过量NaOH溶液 ④加AlCl3溶液 ⑤过滤
A. ③⑤④⑤② B. ③⑤② C.③⑤①② D. ③⑤①⑤②
14. 被严重腐蚀了的铜和铁共同放入盐酸中充分反应后,剩余残渣中只有铜,则溶液中含有的金属阳离子为( )
A. 可能只含有Fe2+ B. 可能只含Cu2+
C. 一定有Fe2+和Cu2+ D. 可能有Cu2+和Fe2+
15. 选择合适的试剂除去下列物质中的杂质(括号内为杂质)
①铜粉(铁粉) ;②银粉(铜粉) 。
16. 如何分离AlCl3和CuCl2的混合物,写出简明的操作步骤。
17. 实验室测定CuSO4·nH2O晶体里结晶水的n值时,出现了三种情况:
① 晶体中含有受热不分解的物质;②晶体尚带兰色,即停止加热;③晶体脱水后放在实验台上冷却再称量。
使实验结果n值偏低的原因是( )
A. ①② B. ①③ C. ②③ D. ①②③
18. 用以下三种途径来制取相等质量的硝酸铜(1)铜与浓硝酸反应(2)铜与稀硝酸反应(3)铜先跟氧气反应生成氧化铜,氧化铜再跟稀硝酸反应
以下叙述中正确的是( )
①三种途径所消耗的铜的物质的量相等 ②三种途径所消耗的硝酸的质的量相等 ③所消耗的铜的物质的量是:途径(3)>途径(1)>途径(2) ④所消耗的硝酸的物质的量是:途径(1)>途径(2)>途径(3)
A. ①④ B. ②④ C. ③④ D. ②③
19. 下列生产胆矾的实验设计能体现“经济、高效、环保”精神的是( )
A. 铜与浓硫酸共热后用水稀释
B. 用铜片为阳极,石墨为阴极,电解稀硫酸
C. 先灼烧铜生成氧化铜,然后再用稀硫酸溶解
D. 适当温度下,使铜片在持续通入空气的稀硫酸中加快腐蚀
20. 用如图所列各装置设计一个实验,验证浓硫酸和木炭粉在加热条件下反应后的各种产物。
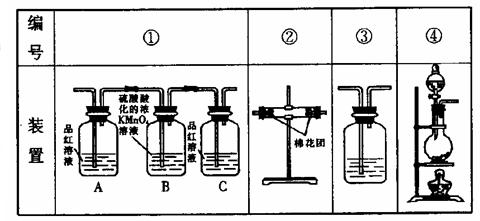
(1) 硫酸与木炭粉在加热条件下反应的化学方程式是:
。
(2) 些装置的连接顺序(按产物气流从左到右的方向)是(填装置的编号)
。
(3)实验时可观察到装置①中A瓶的溶液褪色,C瓶的溶液不褪色。A瓶的作用是 ;B瓶溶液的作用是
;C瓶溶液的作用是
。
(4)装置②中所加的固体药品是 ,可验证的产物是 ,确定装置②在整套装置中位置的理由是
。
(5)装置③中所盛溶液是 ,可验证的产物是 。
[能力提高]
1. 制印刷电路时常用氯化铁溶液作为“腐蚀液”,发生的反应为2FeCl3+Cu=2FeCl2+CuCl2。向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是( )
A. 烧杯中有铜无铁 B. 烧杯中有铁无铜
C. 烧杯中铁、铜都有 D. 烧杯中铁、铜都无
2. 1.6g Cu与50 ml 8mol/L的 充分反应,硝酸的还原产物有NO和
充分反应,硝酸的还原产物有NO和 ,反应后混合溶液中H+浓度为a mol/L(生成水的体积忽略不计),则此时溶液中所含NO3-的物质的量为( )
,反应后混合溶液中H+浓度为a mol/L(生成水的体积忽略不计),则此时溶液中所含NO3-的物质的量为( )
A. (a+1)mol B. (0.4+0.05a)mol
C. (a+0.05)mol D. 0.05(a+1)mol
3. 用足量铜与500 ml稀硝酸完全反应后,将溶液小心蒸发得到Cu(NO3)2·3H2O晶体90.75g。计算:
(1) 被氧化的铜的质量是多少?
(2) 原稀硝酸的物质的量浓度是多少?
(3) 反应中有多少克硝酸被还原? g
4. 将1.92g铜放入100ml含有1.26g  与9.8g
与9.8g
 的混合溶液中,充分反应后生成的NO的体积是多少?(标准状况)
的混合溶液中,充分反应后生成的NO的体积是多少?(标准状况)
5. 下列能发生Cu + 2H2O = Cu(OH)2 + H2↑的是( )
A. 将铁棒与铜棒用导线连接一同插入食盐水中
B. 将铁棒与锌棒用导线连接一同插入硫酸铜溶液中
C. 用铜棒作阳极,石墨作阴极,电解烧碱溶液
D. 用石墨作阳极,铜棒作阴极,电解烧碱溶液
6. 已知氧化铜在高温下可发生分解4CuO 2Cu2O+O2↑,生成Cu2O也能被H2还原为Cu。
2Cu2O+O2↑,生成Cu2O也能被H2还原为Cu。
(1)若将10gCuO在高温下部分分解后,再通入氢气使剩余固体全部还原为铜,消耗0.225g H2,则原氧化铜的分解率是多少?
(2) 若将m gCuO在高温下部分分解后,再通入n g H2,即可使剩余固体全部还原为铜,则氧化铜的分解率是多少?n的取值范围是多少?
7. 将40ml 1.5mol/L的CuSO4溶液与30ml 3mol/L的NaOH溶液混合,生成浅蓝色沉淀,假如溶液中c(Cu2+)或c(OH-)都已变得很小,可忽略,则生成沉淀的组成可表示为( ) D
A. Cu(OH)2 B. CuSO4·Cu(OH)2
C. CuSO4·2Cu(OH)2 D. CuSO4·3Cu(OH)2
8. 实验室用铜和硫酸制取硫酸铜有几种方法:
甲同学进行了下列实验:取6.4g铜片和10ml 18mol/L浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余。他根据自己所学的化学知识,认为烧瓶中还有较多的硫酸剩余。他这样认为的理由是:
。
乙同学认为甲设计的实验方案不好,他自己设计的思路是2Cu+O2?2CuO;CuO+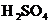 =CuSO4+H2O。对比甲的方案,乙同学的优点是:
=CuSO4+H2O。对比甲的方案,乙同学的优点是:
。
9. 在一定条件下,可实现下图所示的物质之间的转化。
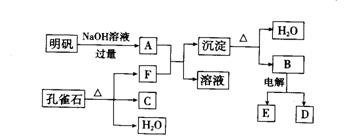
试填写下列空白:
(1)孔雀石的主要成分为Cu2(OH)2CO3,它受热易分解。上图中的F是 。
(3) 写出明矾溶液与过量的NaOH溶液反应的离子方程式
。
(3)图中所得的C、D都是固体,混合后在高温下可发生反应,写出该反应的化学方程式 。
(4)B既可与盐酸反应,又可与NaOH溶液反应,离子方程式分别为
、 。
(5)工业上用电解熔融的B来制单质D,每生成1 mol D的同时,可生成
mol E。
10. 孔雀石和石青是自然界存在的两种碳酸盐类铜矿,它们的化学组成可表示为:
xCuCO3·yCu(OH)2(x、y为正整数且x≤2,y≤2)
(1) 孔雀石和石青分别与过量盐酸反应时,孔雀石耗用的盐酸的物质的量与生成的CO2的物质的量之比为4:1,石青则为3:1。请推算它们的化学组成。
孔雀石 ;石青 。
(2)现有孔雀石和石青混合样品,取两份等质量的样品,在一份中加入过量盐酸,生成CO2 3.36L(标准状况);加热另一份样品使其完全分解,得到CuO20g,试通过计算确定该混合物中孔雀石和石青的物质的量之比 。
高考聚焦
(2002年上海,22题)0.03mol Cu完全熔于硝酸,产生氮的氧化物(NO、 、N2O4)混合气体共0.05mol。该混合气体的平均相对分子质量可能是( )
、N2O4)混合气体共0.05mol。该混合气体的平均相对分子质量可能是( )
A. 30 B. 46 C. 50 D. 66
(2002年上海,30题)某化学课外小组用含铜96%的废铜屑制取胆矾(五水合硫酸铜)。将铜屑放入稀硫酸中,加热并不断鼓入空气,在氧气作用下便生成硫酸铜。
(1)写出生成硫酸铜的化学方程式 。
(2)现用1Kg这种废铜屑理论上能制取胆矾多少千克?
(2) 将胆矾与生石灰、水按质量比依次为1:0.56:100混合配制成无机铜杀菌剂波尔多液。
①此波尔多液中Cu2+离子和Ca2+离子的物质的量比为 (最简单整数比)
② 波尔多液有效成分的化学式可表示为CuSO4·xCu(OH)2·yCa(OH)2,此种配比当x=1时,试确定y的数值。
(二) Cu2(OH)2CO3
(一)CuO
CuO在高温下分解: 。
CuO为黑色而Cu2O为红色,氧化铜可作为铜盐的原料,氧化亚铜可作为制造玻璃、搪瓷的红色颜料。
工业上,主要采用高温冶炼黄铜矿的方法获得铜。这种方法冶炼的铜,其含量为99.5%∽99.7%,还有Ag、Au、Fe、Zn等杂质。要达到电气化生产铜的要求,这种由黄铜矿高温冶炼的铜还必须经过电解精炼,电解精炼得到的铜,其含量高达99.95%∽99.98%。
[典题解悟]
例. 铜是生命必需的元素,也是人类最早使用的金属之一,铜的生产对国计民生各个方面都产生了深远的影响。请完成下列各题:
(1) 在化学反应中,铜元素可表现为0、+1、+2价。
①在西汉古籍中有记载:曾青得铁则化为铜(即曾青CuSO4跟铁反应就生成铜)。试写出该反应的化学方程式 。
②铜器表面有时会生成铜绿Cu2(OH)2CO3,这层铜绿可用化学方法除去。试 写出一个除去铜绿而不损坏器物的化学方程式 。
(2) 铜钱在历史上曾经是一种广泛流通的货币,试从物理性质和化学性质的角度分析为什么铜常用于制造货币。(铜的熔点是1183.4℃,铁的熔点是1534.8℃)
(3) 历史上的“青铜器时期”早于“铁器时期”,而近百年才大量使用铝制品,试分析人类使用这些金属的时间的事实与金属活泼性及冶炼难易的联系
精析:西汉时期的“曾青得铁则化为铜”是湿法冶金术得先驱,Fe+CuSO4=FeSO4+Cu。当铜生成铜绿时,铜元素的化合价升高到+2,所以空气中必有氧化剂参加了反应。因铜在常温下不与稀硫酸反应,而铜绿则能与稀酸反应,所以可考虑用稀硫酸清洗。
2Cu+O2+H2O+CO2=Cu2(OH)2CO3
Cu2(OH)2CO3+4H++=2Cu2++CO2↑+3H2O
根据题给信息以及作货币的实际需要,选择铜作货币不仅是因为铜的熔点比较低,容易铸造成型,同时铜的化学性质比较稳定,不易被腐蚀,加上铜有迷人的光泽。
答案:(1)Fe+CuSO4=Cu+FeSO4
(2)2Cu+O2+CO2+H2O=Cu2(OH)2CO3
Cu2(OH)2CO3+2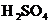 =2CuSO4
+CO2↑+3H2O
=2CuSO4
+CO2↑+3H2O
(3)铜的熔点低,化学性质稳定,有迷人的光泽,易铸造。
(三) 与盐溶液的反应
2 FeCl3 + Cu = 2FeCl2 + CuCl2
Cu + 2AgNO3 = Cu(NO3)2 + 2Ag
(二) 与酸的反应
(1) 铜与非氧化性酸(如盐酸、磷酸等)不反应。
(2) 铜与强氧化性酸(如浓硫酸、硝酸等)能反应,但不生成氢气。
Cu+2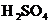 ?CuSO4+SO2↑+2H2O
?CuSO4+SO2↑+2H2O
(一) 铜与非金属的反应
(1) 与氧气反应:
2Cu + O2?2CuO
在潮湿空气中还可发生腐蚀生成绿色的铜锈:
2Cu + O2 + H2O + CO2 = Cu2(OH)2CO3
(2) 与其它非金属的反应:
2Cu + S ? Cu2S
Cu + Cl2  CuCl2
CuCl2
根据铜在金属活动性顺序表中的位置,它应属于不活泼的金属,因此它 置换出酸或水中的氢。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com