
5.下列各溶液中,加入Na和Na2O2都会既放出气体又有固体析出的是( )
A.FeCl2稀溶液 B.NaCl稀溶液
C.饱和Ca(OH)2溶液 D.饱和NaHCO3溶液
4.下列物质中既能与稀硫酸反应又能与氢氧化钠溶液反应的是( )
①NaHCO3 ②Al2O3 ③Al(OH)3 ④Al
A.②④ B.③④ C.①③④ D.全部
3.下列物质在空气中放置不变质的是( )
A.Na2CO3 B.Na2O2 C.NaOH D.Na2O
2.金属钠长期露置在空气中,它的最终产物是( )
A.Na2O B.Na2O2 C.NaOH D.Na2CO3
1.铝是重要的金属材料之一。下列关于铝的叙述中不正确的是( )
A.铝是地壳中含量最多的金属元素 B.常温下铝不能与氧气反应
C.铝既能溶于酸又能溶于强碱溶液 D.铝可用于燃烧弹、信号弹、火箭推进剂
45.(株洲)化学老师张××指导某化学兴趣学习小组进行了一个有趣的实验探究:测定鸡蛋壳的主要成分碳酸钙的质量分数。实验如下:将鸡蛋壳洗净、干燥并捣碎后,称取8.0g放在烧杯里,然后往烧杯中加入足量的稀盐酸50mL(密度1.1g/ml),充分反应后,称得反应剩余物为59.92g(假设其他物质不与盐酸反应)。请回答:
(1)上述稀盐酸的质量为 g,产生二氧气体的质量为 g。
(2)计算该鸡蛋壳中碳酸钙的质量分数。 (要求写出计算过程)
(3)该稀盐酸中HCI的质量分数应不小于多少?(要求写出计算过程)。
(1)55g,3.08
设:碳酸钙的质量为X,氢化氢的质量为Y
CaCO3+2HCl==CaCl2+H2O+CO2↑
100 73 44
X Y 3.08g
100/44=X/3.08g
X=7g
73/44=Y/3.08g
Y=5.11g
碳酸钙的质量分数为7g/8g=87.5%
盐酸中溶质的质量分数是:5.11g/55g=9.3%
48. 解法一:
解:设10g贝壳中碳酸钙的质量为x.
CaCO3 + 2HCl == CaCl2 + H2O + CO2↑
100 44
X 1.76g
100:X ==44:1.76g 求得X==4g
4g÷10g×100%=40%
答:(略)
解法二:
解:设10g贝壳中碳酸钙的质量为x.
CaCO3 - CO2
100 44
X 1.76g
100:X ==44:1.76g 求得X==4g
4g÷10g×100%==40%
答:(略)
解法三:解:设10g贝壳中碳酸钙的质量分数为x. CaCO3 +2HCl ==CaCl2 +H2O +CO2↑
100 44 10gX 1.76g 100:10gX ==44:1.76g 求得X=40%
答:(略)
解法四: 解:设10g贝壳中碳酸钙的质量为x 碳元素的质量:1.76g×C/CO2×100%==0.48g 根据质量守恒定律可得: xC/CaCO3×100%==0.48g x==48÷12 x=4g 4g÷10g×100%==40% 44.(大连)某补钙剂的主要成分是碳酸钙。为测定该补钙剂中碳酸钙的质量分数,现称取一定质量的样品放在烧杯里,向其中加入稀盐酸至不再产生气泡为止(其他成分不含钙元素,不溶于水也不与稀盐酸反应)。过滤,得到滤渣2.5g,将滤液蒸干,得到氯化钙11.1g。计算:⑴该补钙剂中碳酸钙的质量分数;设补钙剂中碳酸钙的质量为x
CaCO3 +2HCl=CaCl2+H2O+CO2 111/100=11.1/x x=10g 10g/10g+2.5g*100%=80%
⑵某人除正常饮食之外,每天需补充0.64g钙元素,则每天需服用这种补钙剂多少克?
40/100*100%=40% 0.64g/40%/80%=2g
43.(海南)为测定贝壳中碳酸钙的含量,小红将贝壳粉碎后,取样品l0g,与足量的稀盐酸充分反应(杂质不与盐酸反应),产生二氧化碳1.76g。计算贝壳中碳酸钙的质量分数。
42.(南京)一碳化学是以分子中只含一个碳原子的化合物(如CO、CH4等)为原料来合成一系列化工原料和燃料的化学,
(1)工业上用天然气和水蒸气在高温条件下发生反应,得到CO和H2,该反应的化学方程式为 ▲ 得到的CO和H2的混合气被称为合成气,合成气在工业上可用于合成一系列化工原料和新型燃料,还可用于冶炼某些金属。
(2)某他学兴趣小组的同学在实验室模拟了合成气的制备,并设计实验验证合成气的还原性。
I.用甲烷和水蒸气在高温条件下反应得到合成气.根据(1)中所写的化学方程式.合成气中CO和H2的质量比为 ▲ 。
Ⅱ.用合成气还原足量氧化铜.实验装置如下图所示:

[设计买验步骤]
①连接好装置并检查气密性。
②装入药品,通人一段时间合成气。
③分别称量装置D、E的质量。
④缓缓通入合成气,加热装置C,使其充分反应。
⑤停止加热,继续通入合成气至恢复到室温。
⑥再次分别称量装置D、E的质量。
[完善实验设计]经过讨论同学们认为,装置E后还应添加一个酒精灯,并在实验步骤
▲ (填实验步骤的序号)中点燃(点燃前应对气体验纯)。
[进行实验]该小组的同学按上述步骤进行实验,并记录了实验现象和数据:
|
|
装置D的质量 |
装置E的质量 |
|
反应前 |
292.4g |
198.2g |
|
反应后 |
296.0g |
201.5g |
①装置C中出现 ▲ 色物质。
②称量数据如右表所示。
[现象分析和数据处理]
①甲同学根据装置C中的现象,认为是合成气中的CO和H2还原了CuO。 .
②乙同学通过对上表数据的分析,推测除了CO和H2以外,制得的合成气中可能还有未反应的CH4,且CH4也还原了CuO。试通过计算说明他的推测依据。
▲
③丙同学提出,实验步骤⑤中通入的气体会带走装置E中的部分水蒸气,使实验产生误差。你认为该误差对乙同学的推测结果是否有影响?
▲ (选填“是”或“否”,并说明理由)。
[拓展探究]该小组同学对于CH4是否真的能够还原氧化铜提出了质疑并进行探究。
查阅资料:甲烷具有还原性,可以还原氧化铜,生成CO2和H2O;
白色的无水硫酸铜遇水会变成蓝色。
 实验设计:该小组同学拟用纯净的甲烷气体和如下装置进行实验。
实验设计:该小组同学拟用纯净的甲烷气体和如下装置进行实验。

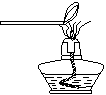
F G I
①上图装置F中盛放的试剂名称是 ▲ 。
②上图装置的正确连接顺序是 ▲ (填字母,且每套装置限用一次)。
[实验反思]除了可能是CH4也还原了CuO外,出现上表数据关系还可能是因为
▲ (写出一个原因,并说明理由)。
▲
(1)CH4+H2O=CO+3H2 (2)I.14:3 Ⅱ.[完善实验设计]② [进行实验]红
[现象分析和数据处理] ②如果只有CO和H。还原足量CuO,合成气中CO与H2的分子个数比为1:3。生成物中碳元素与氢元素的质量比为2;1 如果只有CH4还原足量CuO,生成物中碳元素与氢元索的质量比为3:1 现测得CO2的质量:201.5g--198.2g=3.3g H20的质量:896.0g一292.4g=3.6g
生成物中碳元索与氢元索的质量比:(3·3g×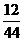 ):(3.6g×
):(3.6g×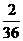 )=9:4
)=9:4
9;4介于2:1和3:1之间,由此可推测出,除了CO和H2以外,制得的合成气中可能还有来反应的CH4,且CH4也还原了CuO。
③否。因为带走水蒸气会使测得的CO2质量偏低·而实际测得的生成物中碳、氢元素的质量比已经大于2 :1,所以对推测结果无影响。(合理叙述均给分)
[拓展探究]澄清石灰水 HGFI
[实验反思]因为根据测得数据计算,生成物中碳、氧元素的质量比太置2:1,所以可能是合成气中参与反应的CO与H2的分子个数比大于1:3(或H2未完全参加反应、
生成的水未被完全吸收等) (合理答案均给分) 。
41.(苏州)下图A-F是实验室制备某些常见气体的装置示意图。
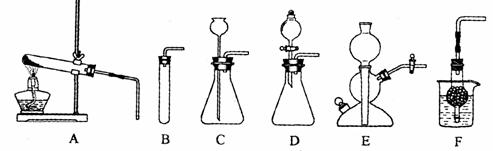
(1)实验室制备CO2的化学方程式为: ▲
可用的发生装置有: ▲ (选填上图字母序号)。
(2)装置E或F相对于装置C在操作方面的优势为: ▲ 。
(3)排水法收集与排空气法收集CO2的比较(分别用体积相同的2个集气瓶收集)
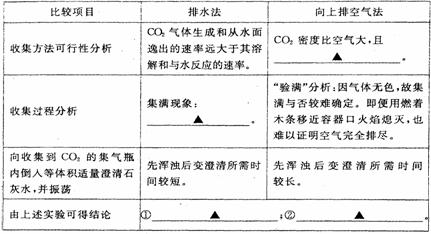
(4)块状石灰石和适量稀盐酸反应至气泡逸出不明显后,测得其残留液pH等于2。此时
取适量反应后溶液,逐滴滴入碳酸钠溶液,并用pH数字探测仪连续监测,得曲线如下
[pH为纵坐标,时间s(秒)为横坐标]:
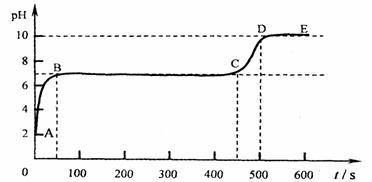
①写出AB段内有关化学方程式 ▲ ,
▲
②写出BC“平台”段化学方程式 ▲ 。
③CD段上升的原因是: ▲ 。

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com